题目内容
13.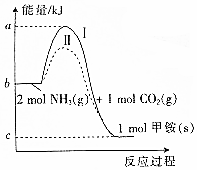 氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.
氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.(1)图中反应为可逆反应,则生成甲铵的反应是放热(填“放热”或“吸热”)反应.
(2)合成甲铵的热化学方程式为CO2(g)+2NH3(g)=H2NCOONH4(s)△H=-(b-c)KJ/mol.
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,其原因是II使用了催化剂,改变了反应的途径,大大降低了活化能.
(4)已知由甲铵合成尿素的反应为NH2COONH4(s)$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2(s)+H2O(l)△H=+dkJ•mol-1,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为CO2(g)+2NH3(g)=CO(NH2)2(l),△H=(-b+c+d)KJ/mol.
分析 (1)反应物总能量高于生成物总能量为放热反应,反应物总能量低于生成物总能量为吸热反应;
(2)依据图中数据可知:2mol氨气与1mol二氧化碳气体生成氨基甲酸铵固体放出热量(b-c)KJ,据此书写热化学方程式;
(3)使用催化剂能够大大降低反应的活化能;
(4)CO2(g)+2NH3(g)=H2NCOONH4(s)△H=-(b-c)KJ/mol①
NH2COONH4(s)$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2(l)△H=+dkJ•mol-1②
依据盖斯定律①+②得CO2(g)+2NH3(g)=CO(NH2)2(l),据此计算反应热.
解答 解:(1)依据图中信息可知:反应物总能量高于生成物总能量,所以该反应为放热反应;
故答案为:放热;
(2)依据图中数据可知:2mol氨气与1mol二氧化碳气体生成氨基甲酸铵固体放出热量(b-c)KJ,所以该反应的热化学方程式:CO2(g)+2NH3(g)=H2NCOONH4(s)△H=-(b-c)KJ/mol;
故答案为:CO2(g)+2NH3(g)=H2NCOONH4(s)△H=-(b-c)KJ/mol;
(3)使用催化剂能够大大降低反应的活化能,依据图中数据可知:II使用了催化剂,改变了反应的途径,大大降低了活化能;
故答案为:II使用了催化剂,改变了反应的途径,大大降低了活化能;
(4)CO2(g)+2NH3(g)=H2NCOONH4(s)△H1=-(b-c)KJ/mol①
NH2COONH4(s)$\frac{\underline{\;\;△\;\;}}{\;}$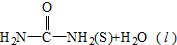 △H2=+dkJ•mol-1②
△H2=+dkJ•mol-1②
依据盖斯定律①+②得CO2(g)+2NH3(g)=CO(NH2)2(l),则该反应的反应热为:△H1+△H2=(-b+c+d)KJ/mol;
故答案为:CO2(g)+2NH3(g)=CO(NH2)2(l),△H=(-b+c+d)KJ/mol.
点评 本题考查了热化学方程式的书写,反应热的计算,明确反应物、生成物能量与反应热效应的关系,熟悉盖斯定律计算反应热的方法是解题关键,题目中等.

| A. | 甲烷的燃烧热为890.3KJ•mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 KJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 KJ•mol-1 | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为: N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 KJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 KJ•mol-1,则2CO2(g)═2CO(g)+O2(g) 反应的△H=+283.0 KJ•mol-1 |
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为250℃,则反应速率v(H2)=0.4 mol•L-1•min-1.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的$\frac{1}{2}$,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
| 物质 | C | H2 | CO |
| △H(kJ/mol) | -393.5 | -285.8 | -283.0 |
(2)能表示H2燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.kJ/mol.
(3)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为应该选择A(填写序号).
A.H2 B.CO C.均可以
理由是相同体积的氢气与一氧化碳完全燃烧氢气放出热量多.
| A. |  CO2的收集 | B. | 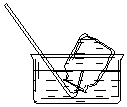 NO的收集 | C. | 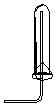 NH3的收集 | D. | 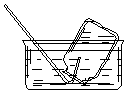 Cl2的收集 |
 ,则下列物质与
,则下列物质与  互为同分异构体的是( )
互为同分异构体的是( )




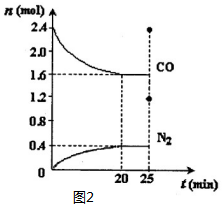 对含氮物质的研究和利用有着极为重要的意义.
对含氮物质的研究和利用有着极为重要的意义.