题目内容
15.图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A、C、D均为无色气体,且气体C的水溶液显碱性.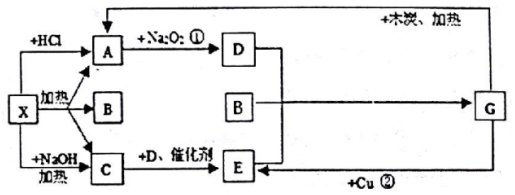
(1)用化学用语按要求填空
X的化学式为:(NH4)2CO3,X中含有化学键类型为离子键、共价键;A的电子式:
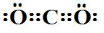 ;G的化学式为HNO3.
;G的化学式为HNO3.(2)写出反应①的化学方程式2Na2O2+2CO2═2Na2CO3+O2.
(3)写出反应②的离子方程式Cu+4H++2NO3_═Cu2++2NO2↑+4H2O.
(4)过量的Fe粉与G的稀溶液反应,向反应后溶液中加入碱溶液,现象是先产生白色沉淀,随后变为灰绿色,最后生成红褐色沉淀,反应的离子方程式为
Fe2++2OH_═Fe(OH)2;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
分析 X为正盐,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3;气体A能与过氧化钠反应,则A为CO2,则X应为(NH4)2CO3,B为H2O;结合转化关系可知,A与过氧化钠反应生成D,则D为O2;C(NH3)与D(O2)催化氧化生成气体E,则E为NO;G与木炭加热生成二氧化碳、与Cu反应生成NO,则G为HNO3,据此结合物质的性质进行解答.
解答 解:X为正盐,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3;气体A能与过氧化钠反应,则A为CO2,则X应为(NH4)2CO3,B为H2O;结合转化关系可知,A与过氧化钠反应生成D,则D为O2;C(NH3)与D(O2)催化氧化生成气体E,则E为NO;G与木炭加热生成二氧化碳、与Cu反应生成NO,则G为HNO3,
(1)根据分析可知,X为(NH4)2CO3,碳酸铵中含有的化学键为离子键和共价键;A为CO2,二氧化碳为共价化合物,分子中含有两个碳氧双键,其在为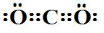 ;G为HNO3,
;G为HNO3,
故答案为:(NH4)2CO3;离子键、共价键;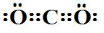 ;HNO3;
;HNO3;
(2)反应①为过氧化钠与水的反应,飞跃的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)反应②为铜与稀硝酸的反应,该反应的离子方程式为:Cu+4H++2NO3_═Cu2++2NO2↑+4H2O,
故答案为:Cu+4H++2NO3_═Cu2++2NO2↑+4H2O;
(4)过量的Fe粉与G(HNO3)的稀溶液反应生成硝酸亚铁、NO和水,向反应后溶液中加入碱溶液,反应生成氢氧化亚铁,氢氧化亚铁不稳定,迅速被氧化,最终变为红褐色的氢氧化铁,所以反应现象为:先产生白色沉淀,随后变为灰绿色,最后生成红褐色沉淀;反应的离子方程式为:Fe2++2OH_═Fe(OH)2、4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:先产生白色沉淀,随后变为灰绿色,最后生成红褐色沉淀;Fe2++2OH_═Fe(OH)2;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
点评 本题考查无机物的推断,注意元素化合物的性质应用,题目难度较大,本题解答时要善于抓住题中信息,为解答该题的关键,也是易错点,学习中要加强信息迁移能力的培养.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案| A. | 元素的种类由最外层电子数决定 | |
| B. | 化学键是存在于分子、原子和离子间的作用力 | |
| C. | 原子的种类由原子核内质子数与中子数共同决定 | |
| D. | 化学反应速率可以决定反应的限度 |
| A. | X单质可以把Y从其氢化物中置换出来 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 与H2化合时X单质比Y单质容易 | |
| D. | X原子的最外层电子数比Y原子的最外层电子数多 |
| A. | 甲烷的燃烧热为890.3KJ•mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 KJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 KJ•mol-1 | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为: N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 KJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 KJ•mol-1,则2CO2(g)═2CO(g)+O2(g) 反应的△H=+283.0 KJ•mol-1 |
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为250℃,则反应速率v(H2)=0.4 mol•L-1•min-1.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的$\frac{1}{2}$,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
| 物质 | C | H2 | CO |
| △H(kJ/mol) | -393.5 | -285.8 | -283.0 |
(2)能表示H2燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.kJ/mol.
(3)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为应该选择A(填写序号).
A.H2 B.CO C.均可以
理由是相同体积的氢气与一氧化碳完全燃烧氢气放出热量多.
| A. | Cu2+、K+、NO${\;}_{3}^{-}$、Cl- | B. | Na+、K+、OH-、Cl- | ||
| C. | Mg2+、Na+、OH-、SO${\;}_{4}^{2-}$ | D. | Ba2+、H+、CO${\;}_{3}^{2-}$、OH- |
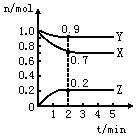 某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示. 2Z.
2Z. +H2C=CH2$\stackrel{一定条件}{→}$
+H2C=CH2$\stackrel{一定条件}{→}$
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 .
.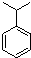 ,N:
,N: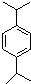 .
.