题目内容
10.某兴趣小组的同学三次实验测得钢质容器中1L水的温度变化如表所示(水的比热容c=4.18J•g-1•℃-1):| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 33.8 |
| ② | 24.7 | 33.7 |
| ③ | 24.9 | 35.9 |
②写出碳完全燃烧的热化学方程式:C(s)+O2(g)=CO2(g)△H=-376.2KJ/mol.
分析 ①由实验①②③可知,三次实验的温度差△T均为9℃,从而根据热量Q=cm△T即可求出燃烧放出的热量;
②燃烧热是指在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.
解答 解:①由实验①②③可知,三次实验的温度差△T均为9℃,即温度的平均变化值为9℃,而热量Q=cm△T=4.18J•g-1•℃-1×1000g×9℃=37620J=37.62KJ,故答案为:37.62KJ;
②燃烧热是指在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.由于1.2g碳的物质的量n=$\frac{1.2g}{12g/mol}$=0.1mol,燃烧放出37.62KJ的热量,则硫的燃烧热为$\frac{37.62KJ}{0.1mol}$=376.2KJ/mol,故碳的燃烧热的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-376.2KJ/mol,
故答案为:C(s)+O2(g)=CO2(g)△H=-376.2KJ/mol.
点评 本题考查了燃烧热的测定实验,应注意的是燃烧热是指在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,书写燃烧热的热化学方程式时,要使可燃物的计量数为1.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
1. 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
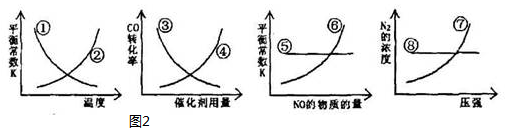
①由表中数据判断△H<0(填“>”、“=”或“<”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为250℃,则反应速率v(H2)=0.4 mol•L-1•min-1.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的$\frac{1}{2}$,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为250℃,则反应速率v(H2)=0.4 mol•L-1•min-1.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的$\frac{1}{2}$,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
18.已知C、H2、CO的燃烧热的数据如表所示:
(1)写出C完全燃烧的热化学方程式:C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol.
(2)能表示H2燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.kJ/mol.
(3)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为应该选择A(填写序号).
A.H2 B.CO C.均可以
理由是相同体积的氢气与一氧化碳完全燃烧氢气放出热量多.
| 物质 | C | H2 | CO |
| △H(kJ/mol) | -393.5 | -285.8 | -283.0 |
(2)能表示H2燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.kJ/mol.
(3)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为应该选择A(填写序号).
A.H2 B.CO C.均可以
理由是相同体积的氢气与一氧化碳完全燃烧氢气放出热量多.
2.以下集气装置中不正确的是( )
| A. |  CO2的收集 | B. |  NO的收集 | C. |  NH3的收集 | D. |  Cl2的收集 |
19.在无色透明的溶液中能大量共存的一组离子是( )
| A. | Cu2+、K+、NO${\;}_{3}^{-}$、Cl- | B. | Na+、K+、OH-、Cl- | ||
| C. | Mg2+、Na+、OH-、SO${\;}_{4}^{2-}$ | D. | Ba2+、H+、CO${\;}_{3}^{2-}$、OH- |
20.下列说法正确的是( )
| A. | 石油分馏可以获得乙烯 | |
| B. | 煤经过气化和液化等物理变化可转化为淸洁燃料 | |
| C. | 聚乙烯塑料制品可用于食品包装 | |
| D. | 天然气和液化气的主要成分都是甲烷 |
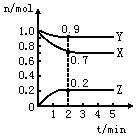 某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示. 2Z.
2Z.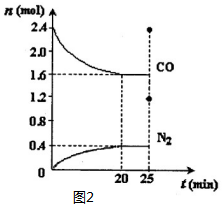 对含氮物质的研究和利用有着极为重要的意义.
对含氮物质的研究和利用有着极为重要的意义.