题目内容
18. 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
(1)写出CO2的结构式O=C=O,N2的电子式
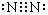 .
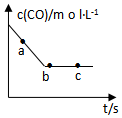
.(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
①则反应速率υ(a)、υ(b)、υ(c)的大小关系是υ(a)>υ(b)=υ(c);
②下列可说明反应到达图中c点的是BC;
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
D.容器中的气体质量或物质的量保持不变
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是温度,且升高温度反应速率将增大.(填“增大”、“减小”、“无影响”).
分析 (1)CO2为共价化合物,碳和氧之间存在2对共用电子对,据此写出此分子的结构式;N2分子氮原子间存在氮氮三键,均满足8电子结构,据此写出电子式;
(2)①该反应中,CO浓度逐渐减小,直至达到平衡状态,根据图象可知,b、c点达到平衡状态,则a点反应速率一定大于b、c;
②bc点已经达到平衡状态,此时正逆反应速率相等,各组分的浓度不变,据此对各选项进行判断;
(3)①对照试验中需要控制变量,根据实验Ⅰ、Ⅱ中不同的反应条件进行判断实验目的;
②根据实验Ⅰ、Ⅲ的反应时间判断温度对该反应速率的影响
解答 解:(1)CO2的结构式为O=C=O,N2的电子式为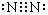 ;故答案为:O=C=O;
;故答案为:O=C=O;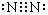 ;
;
(2)①该反应中,CO浓度逐渐减小,直至达到平衡状态,根据图象可知,b、c点达到平衡状态,a点还没有达到平衡状态,则a点反应速率一定大于b、c,即:υ(a)>υ(b)=υ(c),
故答案为:υ(a)>υ(b)=υ(c);
②根据图象曲线变化可知,b、c两点处于平衡状态,
A.化学反应速率与化学计量数成正比,则反应过程中NO、CO、CO2、N2的浓度比值始终为2:2:2:1,所以无法判断是否达到平衡状态,故A错误;
B.CO的浓度不再改变,说明正逆反应速率相等,已经达到平衡状态,故B正确;
C.反应消耗2molNO的同时消耗1molN2,证明正反应速率与逆反应速率相等,各组分浓度不再变化,达到了平衡状态,故C正确;
D.根据质量守恒定律可知容器中的气体质量始终不变,但混合气体的总物质的量不确定,达到平衡时才保持不变,故D错误;
故答案为:BC;
(3)①实验Ⅰ和实验Ⅱ的反应条件中,除了催化剂表面积大小不同以外,其它条件完全相同,说明实验目的是探究催化剂比表面积对反应速率的影响,
故答案为:探究催化剂比表面积对反应速率的影响;
②根据实验Ⅰ和实验Ⅲ可知,反应在不同温度下进行的,可见是探究温度对速率的影响,且升高温度后,达到平衡需要的时间少,说明升高温度,反应速率增大,则反应时间减小,
故答案为:温度;升高温度;增大.
点评 本题考查化学平衡及其影响、化学平衡、化学反应速率的计算、影响反应速率的因素等知识,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力及化学实验能力,注意熟练掌握影响化学平衡、化学反应速率的因素,能够正确判断化学平衡状态.

| A. | 羟基的电子式: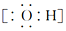 | B. | 乙酸的分子式:CH3COOH | ||
| C. | 溴乙烷的结构简式:CH2BrCH2Br | D. | 乙炔的实验式:CH |
| A. | 该反应的反应物总能量比产物总能量低QkJ | |
| B. | 1mol S(g)与1 mol O2(g)反应,生成1 mol SO2(g),放出Q kJ的热量 | |
| C. | 在S(s)+O2(g)═SO2(g) 反应中,生成1 mol SO2(g)放出的热量大于Q KJ | |
| D. | 1个S(g)与1个O2(g) 完全反应可以放出Q KJ的热量 |
| A. | X单质可以把Y从其氢化物中置换出来 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 与H2化合时X单质比Y单质容易 | |
| D. | X原子的最外层电子数比Y原子的最外层电子数多 |
| A. | 甲烷的燃烧热为890.3KJ•mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 KJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 KJ•mol-1 | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为: N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 KJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 KJ•mol-1,则2CO2(g)═2CO(g)+O2(g) 反应的△H=+283.0 KJ•mol-1 |
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为250℃,则反应速率v(H2)=0.4 mol•L-1•min-1.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的$\frac{1}{2}$,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
| A. | 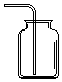 CO2的收集 | B. | 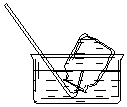 NO的收集 | C. | 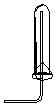 NH3的收集 | D. |  Cl2的收集 |
 ,则下列物质与
,则下列物质与  互为同分异构体的是( )
互为同分异构体的是( )



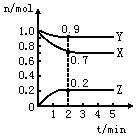 某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示. 2Z.
2Z.