题目内容
13.能量之间可以相互转化:原电池可将化学能转化为电能.(1)下列反应能设计成原电池的是①.
①2FeCl3+Fe═3FeCl2
②AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl
③NaOH+HCl═NaCl+H2O
(2)根据(1)中所选的反应设计成原电池如图1,请在图中完成电极材料及电解质溶液的标注.
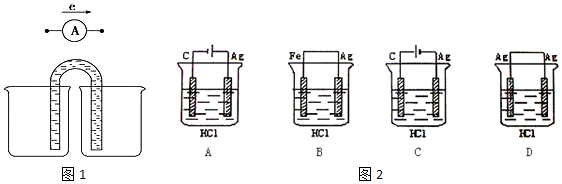
写出该电池的正极反应式:2Fe3++2e-=2Fe2+,电池工作的时候,盐桥中的阴离子移向负极(填“负极”,“正极”或“不移动”).
(3)①欲完成2HCl+2Ag=2AgCl↓+H2↑,设计了图2四个实验,你认为可行的实验是A.
②根据所选的装置,写出阳极(或负极)的电极反应式:Cl-+Ag-e-=AgCl↓,反应一段时间后,溶液的pH变化是A(填序号).
A.变大B.变小C.不变
③若有1.08g Ag被消耗,该原电池转移的电子数目是0.01mol.
分析 (1)能设计成原电池的反应必须是自发进行的放热的氧化还原反应;
(2)将2FeCl3+Fe═3FeCl2设计成原电池反应,则Fe为负极,正极可为碳棒等,负极电解质溶液为FeCl2,正极电解质溶液为FeCl3;
(3)盐酸和银不能自发的进行氧化还原反应,所以不能设计成原电池,只能设计成电解池,失电子的物质作电解池阳极,金属或导电的非金属作电解池阴极,失电子的物质作电解质溶液,据此分析解答.
解答 解:(1)能设计成原电池的反应应是能自发进行的氧化还原反应,①为氧化还原反应,且反应放热,可设计成原电池,②为吸热反应,③为中和反应,没有电子的转移,不能设计成原电池,故答案为:①;
(2)由方程式Fe+2FeCl3=3FeCl2可知,Fe被氧化,为原电池的负极,负极反应为Fe-2e-=Fe2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,负极电解质溶液为FeCl2,正极电解质溶液为FeCl3,原电池工作时,阴离子向负极移动,装置图为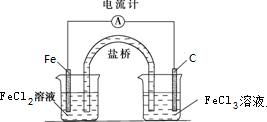 ,
,
故答案为: ;2Fe3++2e-=2Fe2+;负极;
;2Fe3++2e-=2Fe2+;负极;
(3)①2HCl+2Ag=2AgCl↓+H2↑不能自发进行,所以必须设计成电解池,该反应中银失电子,所以银作电解池阳极,金属或导电的非金属作电解池阴极,该反应中氯化氢得电子生成氢气,则选取盐酸作电解质溶液,所以A选项符合条件,
故选A;
②根据所选的装置,银作电解池阳极,电极反应式:Cl-+Ag-e-=AgCl↓,由总反应2HCl+2Ag=2AgCl↓+H2↑,则反应一段时间后,消耗HCl,则溶液的pH变化是变大,故答案为:Cl-+Ag-e-=AgCl↓;A;
③由Cl-+Ag-e-=AgCl↓,若有1.08g Ag被消耗,该原电池转移的电子数目是$\frac{1.08g}{108g/mol}$×1=0.01mol,
故答案为:0.01mol.
点评 本题考查原电池、电解池的设计,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,难度不大,明确原电池的构成条件及反应必须是放热反应是解本题的关键.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
 ,写出气体甲的电子式
,写出气体甲的电子式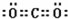 .
.


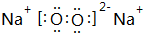 ;
;