题目内容
11.电解及其原理在化工生产中得到广泛应用,下列说法合理的是( )| A. | 电镀铜时用待镀的金属制品作阳极、铜作阴极 | |
| B. | AlCl3熔点低,电解熔融AlCl3冶炼铝更节能 | |
| C. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| D. | 氯碱工业实际是指电解饱和食盐水的工业生产 |
分析 A、电镀铜时用待镀的金属制品作阴极、铜作阳极;
B、氯化铝是共价化合物不能导电;
C、电解精炼铜,阳极上的锌和铁也会失电子生成离子,阳极泥是银、金等;
D、氯碱工业是生成烧碱和氯气的工业.
解答 解:A、电镀过程中,镀件作阴极,镀层金属作阳极,所以电镀铜时用待镀的金属制品作阴极、铜作阳极,故A错误;
B、氯化铝是共价化合物不能导电,工业上是电解熔融的氧化铝制备铝,故B错误;
C、电解精炼铜,阳极上的锌和铁也会失电子生成离子,阳极泥是银、金等,故C错误;
D、氯碱工业是生成烧碱和氯气的工业,故D正确;
故选D.
点评 本题考查了电解池、原电池原理的分析判断,电极反应和电极判断是解题关键,掌握基础是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列叙述正确的是( )
| A. | 对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 | |
| B. | CO燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=+285.8kJ/mol | |
| C. | 反应2Mg+CO2=2MgO+C△H<0从熵变角度看,不可自发进行 | |
| D. | 在密闭容器中,2HI(g)?H2(g)+I2(g)△H=+14.9kJ/mol,若投入NA个HI分子,反应平衡时,吸热7.45kJ |
19.下列说法正确的是(NA为阿伏加德罗常数的值)( )
| A. | NA个Fe(OH)3胶体粒子的质量为107 g | |
| B. | 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA | |
| D. | 1 mol Na2O2固体中含离子总数为4NA |
6.下列反应属于取代反应的是( )
| A. | 由乙酸和乙醇制乙酸乙酯 | B. | 由乙醇制乙烯 | ||
| C. | 由丙烯与溴制1,2-二溴丙烷 | D. | 由甲苯氧化制苯甲酸 |
16.Na和Na+两种粒子中,相同的是( )
①核电荷数、②核外电子层数、③最外层电子数、④核内质子数.
①核电荷数、②核外电子层数、③最外层电子数、④核内质子数.
| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①④ |
17.检验HCl气体中是否混有Cl2可用( )
| A. | 干燥的蓝色石蕊试纸 | B. | 硝酸银溶液 | ||
| C. | 干燥的有色布条 | D. | 湿润的碘化钾淀粉试纸 |
18.课外实验小组为了探究锌与盐酸反应过程中的化学反应速率的变化,在100mL稀盐酸中加入足量的锌粉,标准状况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
(1)哪一时间段2~3 min(指0~1、1~2、2~3、3~4、4~5min,下同)反应速率最大,可能的原因是该反应是放热反应,此时温度高.
(2)哪一段时段的反应速率最小4~5min,原因是H+浓度小.
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为0.1mol/(L•min).
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.蒸馏水B.CH3COONa固体 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是AB(填编号).
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)哪一段时段的反应速率最小4~5min,原因是H+浓度小.
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为0.1mol/(L•min).
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.蒸馏水B.CH3COONa固体 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是AB(填编号).
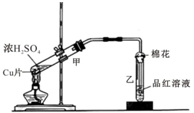 如图为浓硫酸与铜片反应的装置.请回答:
如图为浓硫酸与铜片反应的装置.请回答: