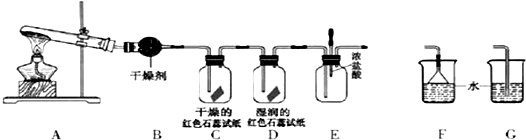
题目内容
3.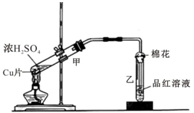 如图为浓硫酸与铜片反应的装置.请回答:
如图为浓硫酸与铜片反应的装置.请回答:(1)浓硫酸与铜片反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)反应一段时间后,试管乙中品红溶液的现象是品红溶液褪色.
(3)下列有关该实验的说法,不正确的是AD.
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况)
分析 (1)铜与浓硫酸反应生成硫酸铜、二氧化硫和水,据此写出反应的化学方程式;
(2)二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,加热时会恢复原来的颜色;
(3)A.该反应中浓硫酸只体现酸性和氧化性;
B.试管乙中含有碱液的棉花,防止二氧化硫散失到空气中,造成大气污染;
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,含有铜离子的溶液,溶液显蓝色;
D.含0.04mol溶质的浓硫酸与足量的铜片反应,随着反应的进行浓度减小,稀硫酸与铜不反应.
解答 解:(1)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫能和有色物质生成无色物质,二氧化硫能使品红溶液褪色,所以二氧化硫具有漂白性;但生成的无色物质不稳定,加热时会恢复原来的颜色;
故答案为:品红溶液褪色;
(3)A.该反应中浓硫酸只体现酸性和氧化性,故A错误;
B.试管乙中含有碱液的棉花,防止二氧化硫散失到空气中,造成大气污染,其作用是吸收过量的SO2,防止环境污染,故B正确;
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,含有铜离子的溶液,溶液显蓝色,故C正确;
D.含0.04mol溶质的浓硫酸与足量的铜片反应,随着反应的进行浓度减小,稀硫酸与铜不反应,所以收集到SO2的体积在标准状况小于448mL,故D错误;
故选:AD.
点评 本题考查了浓硫酸的化学性质、二氧化硫的性质及检验方法,题目难度中等,注意掌握浓硫酸的化学性质,明确二氧化硫的漂白性是暂时的,加热时会恢复原来的颜色.

| A. | 电镀铜时用待镀的金属制品作阳极、铜作阴极 | |
| B. | AlCl3熔点低,电解熔融AlCl3冶炼铝更节能 | |
| C. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| D. | 氯碱工业实际是指电解饱和食盐水的工业生产 |
| A. | 离子化合物可能含共价键 | B. | 共价化合物不可能含离子键 | ||
| C. | 离子化合物中一定含离子键 | D. | 共价化合物中不含离子键 |