题目内容
4.某温度下,饱和石灰水的溶解度为Sg,密度为ρg/mL,向足量该饱和溶液中加入mgCaO,充分作用后,恢复到原来温度,下列有关说法不正确的是( )| A. | 最终得到沉淀的质量大于$\frac{37m}{28}$g | |
| B. | 该饱和溶液质量百分比浓度为$\frac{s}{100+s}$% | |
| C. | 最终所得溶液c(OH-)不变 | |
| D. | 该饱和溶液中溶质物质的量浓度为$\frac{1000ρs}{74(100+s)}$mol/L |
分析 A.mg CaO溶于水发生反应:CaO+H2O═Ca(OH)2,反应生成氢氧化钙的质量为$\frac{37m}{28}$g,由于原饱和溶液中溶剂减少,则会析出部分溶质,所以得到沉淀的质量大于$\frac{37m}{28}$g;
B.饱和溶液中溶质质量分数w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%=$\frac{溶解度}{100+溶解度}$×100%;
C.温度不变,饱和溶液中溶质的浓度不变,则溶液中氢氧根离子浓度不变;
D.根据c=$\frac{1000ρw}{M}$计算出该饱和溶液的物质的量浓度.
解答 解:A.mg CaO溶于水发生反应:CaO+H2O═Ca(OH)2,反应生成氢氧化钙的质量为:$\frac{74}{56}$×mg=$\frac{37m}{28}$g,由于原饱和溶液中溶剂减少,则会析出部分溶质,所以最终得到的沉淀的质量大于$\frac{37m}{28}$g,故A正确;
B.该饱和溶液的溶解度为sg,则该饱和溶液中溶质的质量分数为:$\frac{Sg}{100+sg}$×100%=$\frac{100s}{100+s}$%,故B错误;
C.最终得到的还是氢氧化钙的饱和溶液,由于温度相同,则溶液中氢氧根离子浓度不变,故C正确;
D.该饱和溶液的质量分数为:$\frac{Sg}{100+sg}$×100%,该溶液的物质的量浓度为:c=$\frac{1000ρw}{M}$=$\frac{1000ρs}{74(100+s)}$mol/L,故D正确;
故选B.
点评 本题考查了物质的量浓度与溶质质量分数的计算、饱和溶液的计算,题目难度中等,注意明确饱和溶液特点,熟练掌握物质的量浓度与溶质质量分数的转化关系.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
4.下列说法正确的是( )
| A. | Fe不能与水蒸气发生化学反应 | |
| B. | 白色Fe(OH)2在空气中放置最终变成灰绿色 | |
| C. | 铝可以与氢氧化钠溶液发生反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | |
| D. | 氯化铁溶液不能与铜单质发生反应 |
12.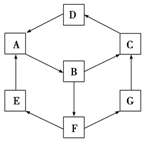 如图是无机物A~G在一定条件下的转化关系(部分产物及反应条件未列出).已知:①A、B、C、D、G含有同种元素.
如图是无机物A~G在一定条件下的转化关系(部分产物及反应条件未列出).已知:①A、B、C、D、G含有同种元素.
②
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀;B也能将一种氧化物氧化为F,F是含有三种元素的化合物,稀的F溶液与A反应生成E、G.
根据以上信息填空:
(1)写出D的化学式:Fe2O3.
(2)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色.
(3)写出下列反应的化学方程式:
E→A4H2+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4H2O;
A→B2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(4)B→F的离子方程式为;G与次氯酸反应的离子方程式为H++2Fe2++HClO═2Fe3++Cl-+H2O.
 如图是无机物A~G在一定条件下的转化关系(部分产物及反应条件未列出).已知:①A、B、C、D、G含有同种元素.
如图是无机物A~G在一定条件下的转化关系(部分产物及反应条件未列出).已知:①A、B、C、D、G含有同种元素.②
| 物质 | 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色 | 黄色 | 红褐色 | 红棕色 | 浅绿色 |
根据以上信息填空:
(1)写出D的化学式:Fe2O3.
(2)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色.
(3)写出下列反应的化学方程式:
E→A4H2+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4H2O;
A→B2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(4)B→F的离子方程式为;G与次氯酸反应的离子方程式为H++2Fe2++HClO═2Fe3++Cl-+H2O.
16.下列仪器常用于物质分离的是( )
①漏斗
②试管
③蒸馏烧瓶
④天平
⑤分液漏斗
⑥研钵.
①漏斗
②试管
③蒸馏烧瓶
④天平
⑤分液漏斗
⑥研钵.
| A. | ①③④ | B. | ①②⑥ | C. | ①③⑤ | D. | ①②⑥ |
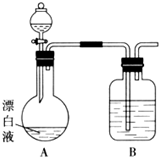 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.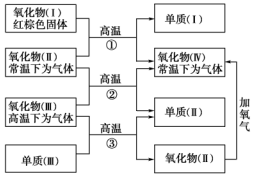 以下一些氧化物和单质之间可发生如图所示的反应:
以下一些氧化物和单质之间可发生如图所示的反应: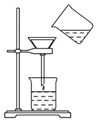 将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:
将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题: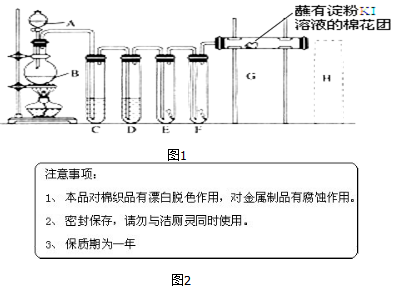
 .
.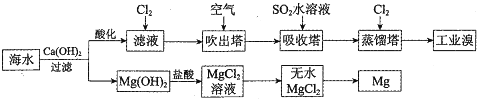
 _.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应
_.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应