题目内容
16.下列仪器常用于物质分离的是( )①漏斗
②试管
③蒸馏烧瓶
④天平
⑤分液漏斗
⑥研钵.
| A. | ①③④ | B. | ①②⑥ | C. | ①③⑤ | D. | ①②⑥ |
分析 实验室常用于分离的操作有过滤、蒸发、蒸馏、萃取、分液等,常用的仪器有普通漏斗、分液漏斗、蒸馏烧瓶等仪器.
解答 解:①漏斗用于分离固体和液体混合物,故选;
②试管常用于物质的制备、发生装置,故不选;
③蒸馏烧瓶常用于分离沸点不同的液体混合物,故选;
④托盘天平常用于称量固体的质量,故不选;
⑤分液漏斗常用于分离互不相溶的液体混合物,故选;
所以用来分离的仪器有①③⑤.
故选C.
点评 本题考查实验室常见仪器的使用,题目难度不大,注意常见基础知识的积累,明确物质的分离操作方法和仪器的使用是解题的关键.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
16. X、Y、Z、W处于同一周期的四种短周期元素,其原子序数逐渐增大,X、W分别是本周期原子半径最大和最小的主族元素,Y单质在工业上用电解其氧化物的方法制取,Y、Z形成的单质有如下转化关系图.下列说法正确的是( )
X、Y、Z、W处于同一周期的四种短周期元素,其原子序数逐渐增大,X、W分别是本周期原子半径最大和最小的主族元素,Y单质在工业上用电解其氧化物的方法制取,Y、Z形成的单质有如下转化关系图.下列说法正确的是( )
 X、Y、Z、W处于同一周期的四种短周期元素,其原子序数逐渐增大,X、W分别是本周期原子半径最大和最小的主族元素,Y单质在工业上用电解其氧化物的方法制取,Y、Z形成的单质有如下转化关系图.下列说法正确的是( )
X、Y、Z、W处于同一周期的四种短周期元素,其原子序数逐渐增大,X、W分别是本周期原子半径最大和最小的主族元素,Y单质在工业上用电解其氧化物的方法制取,Y、Z形成的单质有如下转化关系图.下列说法正确的是( )| A. | Y、Z形成的化合物可利用离子反应制备 | |
| B. | X、Z形成的化合物可能含共价键 | |
| C. | 化合物XW能促进水的电离 | |
| D. | Y元素只能存在于阳离子中 |
4.某温度下,饱和石灰水的溶解度为Sg,密度为ρg/mL,向足量该饱和溶液中加入mgCaO,充分作用后,恢复到原来温度,下列有关说法不正确的是( )
| A. | 最终得到沉淀的质量大于$\frac{37m}{28}$g | |
| B. | 该饱和溶液质量百分比浓度为$\frac{s}{100+s}$% | |
| C. | 最终所得溶液c(OH-)不变 | |
| D. | 该饱和溶液中溶质物质的量浓度为$\frac{1000ρs}{74(100+s)}$mol/L |
11.甲溶液的pH为4,乙溶液的pH为2,甲溶液与乙溶液的c(H+)之比为( )
| A. | 100 | B. | $\frac{1}{100}$ | C. | 2 | D. | $\frac{1}{2}$ |
1.在含有c(NH4Cl)=3c(AlCl3)的溶液中滴加一定量的稀NaOH溶液,则下列离子方程式不符合实际反应情况的是( )
| A. | Al3++3NH4++6OH-=Al(OH)3↓+3NH3•H2O | |
| B. | 2Al3++NH4++7OH-=2Al(OH)3↓+NH3•H2O | |
| C. | Al3++3NH4++7OH-=AlO2-+3NH3•H2O+2H2O | |
| D. | Al3++5NH4++9OH-=AlO2-+5NH3•H2O+2H2O |
8.下列有关离子检验的操作和实验结论都正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定含有NH4+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
5.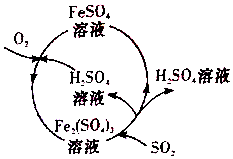 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )| A. | 该过程中可得到化工产品H2SO4 | |
| B. | 该工艺流程是除去煤燃烧时产生的SO2 | |
| C. | 该过程中化合价发生改变的元素为Fe和S | |
| D. | 图中涉及到的反应之一为Fe2(SO4)3+SO2+2H2O═2FeSO4+2H2SO4 |
6. I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应①:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应②:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应③:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应①和反应②在不同温度时的平衡常数及其大小关系如表
(1)推测反应③是吸热反应(填“吸热”或“放热”)
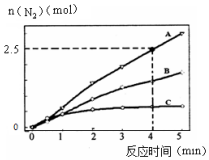
(2)相同条件下,反应①在2L密闭容器内,选用不同催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当温度不变时,说明反应已经达到平衡.
 I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.已知:反应①:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应②:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应③:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应①和反应②在不同温度时的平衡常数及其大小关系如表
| 温度/K | 反应① | 反应② | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应①在2L密闭容器内,选用不同催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当温度不变时,说明反应已经达到平衡.