题目内容
13.实验室用如图1装置制取氯气,并用氯气进行实验.回答下列问题: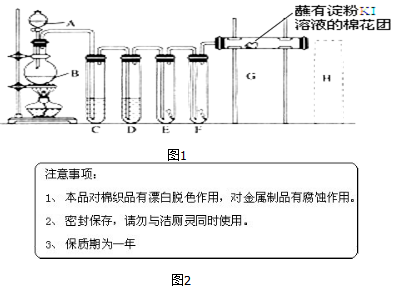
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)D中放入浓H2SO4,其目的是干燥氯气.
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是:E中布条不褪色,F中布条褪色,对比E和F中现象的差异可得出的结论及解释是氯气不具有漂白性,具有漂白性的为次氯酸.
(4)G处的现象是棉花团变蓝.
(5)画出H处尾气吸收装置图并注明试剂
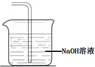 .
.(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生.某品牌消毒液包装上说明如图2.
①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:Cl-+ClO-+2H+=Cl2↑+H2O.
②需“密闭保存”的原因消毒液的有效成分NaClO能与空气中的CO2作用,使其变质;
③分析“对金属制品有腐蚀作用”的原因可能是NaClO有强氧化性,而一般金属具有较强还原性;
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层.外层的优氯净 Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去.
①亚硫酸钠将水中多余次氯酸除去的离子反应方程式为SO32-+HClO═SO42-+Cl-+H+.
②亚硫酸钠溶液在空气中易变质,请完整写出检验亚硫酸钠溶液是否变质的实验操作方案取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质..
分析 实验室用浓盐酸与二氧化锰加热反应制备氯气,浓盐酸具有挥发性,制备的氯气中含有氯化氢、水,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,依次通过干燥有色布条、湿润有色布条验证氯气是否具有漂白性,再通过G装置验证氯气的氧化性,氯气有毒,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收尾气.
(1)MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气、氯化锰和水;
(2)要验证氯气是否具有漂白性,应让干燥的氯气依次通过干燥有色布条、湿润有色布条;
(3)依据氯气不具有漂白性,具有漂白性的是氯气与水反应生成的次氯酸解答;
(4)依据氯气与碘化钾反应生成单质碘,碘遇到淀粉变蓝解答;
(5)氯气有毒不能直接排放到空气中,氯气能够与碱反应,可以用氢氧化钠溶液吸收过量的氯气;
(6)①次氯酸根离子与氯离子发生氧化还原反应生成氯气和水;
②消毒液有效成分是次氯酸盐与二氧化碳和水生成的次氯酸,次氯酸不稳定,见光分解;
③次氯酸钠具有强的氧化性,能够氧化铁生成三价铁离子;
(7)①次氯酸具有强氧化性,能够与亚硫酸根离子发生氧化还原反应;
②亚硫酸钠若变质,溶液中会存在硫酸钠,先用过量盐酸除去亚硫酸根离子,然后用氯化钡检验是否含有硫酸根离子,从而判断亚硫酸钠是否变质.
解答 解:(1)MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气、氯化锰和水,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)D中浓硫酸作用为干燥氯气,防止水蒸气对氯气漂白性检验造成干扰;
故答案为:干燥氯气;
(3)干燥的氯气依次通过E中红色干布条,F中红色湿布条,看到现象为E中布条不褪色,F中布条褪色,说明氯气不具有漂白性,具有漂白性的为次氯酸;
故答案为:E中布条不褪色,F中布条褪色;氯气不具有漂白性,具有漂白性的为次氯酸;
(4)氯气具有强的氧化性,与碘化钾反应生成单质碘,碘遇到淀粉变蓝,所以看到现在为:棉花团变蓝;
故答案为:棉花团变蓝;
(5)氯气有毒不能直接排放到空气中,氯气能够与碱反应,可以用氢氧化钠溶液吸收过量的氯气,装置如图所示: ;
;
故答案为: ;
;
(6)①次氯酸根离子与氯离子发生氧化还原反应生成氯气和水,离子方程式:Cl-+ClO-+2H+=Cl2↑+H2O;
故答案为:Cl-+ClO-+2H+=Cl2↑+H2O;
②消毒液有效成分是次氯酸盐与二氧化碳和水生成的次氯酸,次氯酸不稳定,见光分解,所以应该密封保存;
故答案为:消毒液的有效成分NaClO能与空气中的CO2作用,使其变质;
③NaClO具有漂白作用,利用了NaClO的氧化性,而金属具有还原性,发生了氧化还原反应,对金属腐蚀,
故答案为:NaClO有强氧化性,而一般金属具有较强还原性;
(7)①亚硫酸根离子与次氯酸反应生成硫酸根离子、氯离子,反应的离子方程式为:SO32-+HClO═SO42-+Cl-+H+,
故答案为:SO32-+HClO═SO42-+Cl-+H+;
②亚硫酸钠溶液在空气中易变质,则溶液中会存在硫酸根离子,所以判断亚硫酸钠溶液是否变质的方法为:取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质,
故答案为:取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质.
点评 本题以氯气的制备为载体考查了氯气的性质,题目综合性较强,侧重考查依据所学知识分析问题、解决问题的能力,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 最终得到沉淀的质量大于$\frac{37m}{28}$g | |
| B. | 该饱和溶液质量百分比浓度为$\frac{s}{100+s}$% | |
| C. | 最终所得溶液c(OH-)不变 | |
| D. | 该饱和溶液中溶质物质的量浓度为$\frac{1000ρs}{74(100+s)}$mol/L |
| A. | Al3++3NH4++6OH-=Al(OH)3↓+3NH3•H2O | |
| B. | 2Al3++NH4++7OH-=2Al(OH)3↓+NH3•H2O | |
| C. | Al3++3NH4++7OH-=AlO2-+3NH3•H2O+2H2O | |
| D. | Al3++5NH4++9OH-=AlO2-+5NH3•H2O+2H2O |
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定含有NH4+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 无色气体 | B. | 易液化 | C. | 极易溶于水 | D. | 有刺激性气味 |
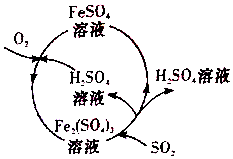 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )| A. | 该过程中可得到化工产品H2SO4 | |
| B. | 该工艺流程是除去煤燃烧时产生的SO2 | |
| C. | 该过程中化合价发生改变的元素为Fe和S | |
| D. | 图中涉及到的反应之一为Fe2(SO4)3+SO2+2H2O═2FeSO4+2H2SO4 |
| A. |  滴加药品的使用 | B. |  移走加热的蒸发皿 | ||
| C. |  液体药品的取用 | D. |  稀释浓硫酸 |
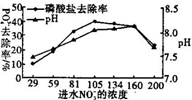 某文献报道可将ASBBR(一种生物膜反应器)用在有PO43-存在的环境中除磷,有一类微生物可在其中将PO43-还原为PH3,这项研究为解决含磷污染物的净化问题提供了新思路.某课题组在无氧环境中,用某腌制厂中含NO3-的废水对上述磷酸盐还原系统的除磷效率进行实验分析.
某文献报道可将ASBBR(一种生物膜反应器)用在有PO43-存在的环境中除磷,有一类微生物可在其中将PO43-还原为PH3,这项研究为解决含磷污染物的净化问题提供了新思路.某课题组在无氧环境中,用某腌制厂中含NO3-的废水对上述磷酸盐还原系统的除磷效率进行实验分析.