题目内容
解释下列事实的方程式不正确的是( )
| A、次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | ||
| B、硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | ||
| C、已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+
C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | ||
| D、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3?H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.次氯酸钙溶液中通人过量二氧化碳,生成HClO和碳酸氢钙;
B.亚硫酸具有还原性,在空气中可被氧化生成硫酸;
C.利用盖斯定律计算;
D.当加入3molBa(OH)2时,反应的n(Fe3+):n(SO42-)=1:2,离子方程式不符合反应实际.
B.亚硫酸具有还原性,在空气中可被氧化生成硫酸;
C.利用盖斯定律计算;
D.当加入3molBa(OH)2时,反应的n(Fe3+):n(SO42-)=1:2,离子方程式不符合反应实际.
解答:
解:A.次氯酸钙溶液中通人过量二氧化碳,生成HClO和碳酸氢钙,反应的离子方程式为ClO-+H2O+CO2═HCO3-+HClO,故A正确;
B.亚硫酸具有还原性,在空气中可被氧化生成硫酸,反应的化学方程式为2H2SO3+O2═2H2SO4,故B正确;
C.已知:①Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol
②CO(g)+
O2(g)═CO2(g)△H=-283.0 kJ/mol
③C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol,
则利用盖斯定律将③×6-②×6-①×2可得4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol,故C正确;
D.当加入3molBa(OH)2时,反应的n(Fe3+):n(SO42-)=1:2,离子方程式不符合反应实际,当Ba(OH)2不足时,可发生2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓,故D错误.
故选D.
B.亚硫酸具有还原性,在空气中可被氧化生成硫酸,反应的化学方程式为2H2SO3+O2═2H2SO4,故B正确;
C.已知:①Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol
②CO(g)+
| 1 |
| 2 |
③C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol,
则利用盖斯定律将③×6-②×6-①×2可得4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol,故C正确;
D.当加入3molBa(OH)2时,反应的n(Fe3+):n(SO42-)=1:2,离子方程式不符合反应实际,当Ba(OH)2不足时,可发生2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓,故D错误.
故选D.
点评:本题考查化学反应及离子反应,明确反应的实质是解答的关键,注意参加反应的物质的量判断可能发生的反应以及反应物的物质的量的关系.

练习册系列答案
相关题目
排放到大气的物质往往对环境有利弊二重性.下列相关叙述与事实不符的是( )
| A、植物光合作用需要CO2,但是大气中CO2过多引起温室效应会导致气候恶化 |
| B、汽车尾气中的NO会污染城市空气,雷电产生的NO会转化为NO3- 并随雨水滋养地表植物 |
| C、臭氧层中的O3可以吸收宇宙射线福佑生灵,地表上的O3却可能伤害人的呼吸道 |
| D、少量Cl2可用于水体净化消毒,大量Cl2会导致水体富营养化 |
用下列实验装置进行相应实验,设计正确且能达到实验目的是( )
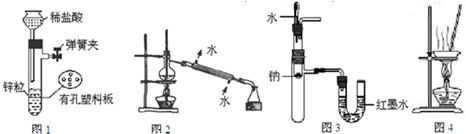

| A、用图1所示装置制取少量H2 |
| B、用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物 |
| C、用图3所示装置验证Na和水反应的热效应 |
| D、用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、在1L 0.1mol/L的醋酸溶液中所含分子数目小于0.1NA |
| B、质量相同的N2和CO中,含有的电子数均为14NA |
| C、标准状况下,11.2L氮气和22.4L氢气在一定条件下充分反应,原子数目小于3NA |
| D、在V L 0.1mol/L的氯化铁溶液中,若Fe3+的数目为NA,Cl-的数目大于3NA |
已知过氧化铬(CrO5)的结构式如下图所示,过氧化铬不稳定,溶于水生成过氧铬酸;溶于酸生成铬(Ⅲ)盐(绿色)并放出氧气,反应方程式为:4CrO5+12H+═4Cr3++7O2+6H2O,下列有关说法正确的是( )


| A、CrO5中Cr元素的化合价为+10 |
| B、过氧化铬中含有极性共价键、非极性共价键和离子键 |
| C、过氧化铬是酸性氧化物,具有较强的氧化性 |
| D、上述反应每转移0.2mol电子就能生成2.24L O2 |
化学与生产和生活密切相关,下列说法正确的是( )
| A、误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
| B、变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |
| C、浸泡过高锰酸钾溶液的硅藻土放于水果箱内是为了延长水果保鲜期 |
| D、安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
下列除杂操作可行的是( )
| A、通过浓硫酸除去HCl中的H2O |
| B、通过灼热的CuO除去H2中的CO |
| C、通过灼热的镁粉除去N2中的O2 |
| D、通过水除去CO中的CO2 |
