题目内容
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、在1L 0.1mol/L的醋酸溶液中所含分子数目小于0.1NA |
| B、质量相同的N2和CO中,含有的电子数均为14NA |
| C、标准状况下,11.2L氮气和22.4L氢气在一定条件下充分反应,原子数目小于3NA |
| D、在V L 0.1mol/L的氯化铁溶液中,若Fe3+的数目为NA,Cl-的数目大于3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.醋酸溶液中存在醋酸分子和水分子;
B.没有告诉具体的质量,无法计算氮气和一氧化碳的物质的量及含有的电子数;
C.根据质量守恒计算出充分反应后原子的物质的量及数目;
D.氯化铁溶液中,铁离子部分水解,铁离子数目减少,所以铝离子数目大于铁离子数目的3倍.
B.没有告诉具体的质量,无法计算氮气和一氧化碳的物质的量及含有的电子数;
C.根据质量守恒计算出充分反应后原子的物质的量及数目;
D.氯化铁溶液中,铁离子部分水解,铁离子数目减少,所以铝离子数目大于铁离子数目的3倍.
解答:
解:A.在1L 0.1mol/L的醋酸溶液中含有溶质醋酸0.1mol,由于醋酸溶液中含有水分子,所以溶液中含有的分子的物质的量大于0.1mol,所含分子数目大于0.1NA,故A错误;
B.缺少氮气和一氧化碳的质量,无法计算二者含有的电子数,故B错误;
C.标准状况下,11.2L氮气和22.4L氢气的物质的量分别为0.5mol、1mol氮气,混合物含有1mol氮原子、2mol氢原子,总共含有3mol原子,根据质量守恒,反应后的混合物中含有的原子的物质的量不变,所以原子数目等于3NA,故C错误;
D.V L 0.1mol/L的氯化铁溶液中,铁离子部分水解,溶液中铁离子数目减少,若Fe3+的数目为NA,则Cl-的数目大于3NA,故D正确;
故选D.
B.缺少氮气和一氧化碳的质量,无法计算二者含有的电子数,故B错误;
C.标准状况下,11.2L氮气和22.4L氢气的物质的量分别为0.5mol、1mol氮气,混合物含有1mol氮原子、2mol氢原子,总共含有3mol原子,根据质量守恒,反应后的混合物中含有的原子的物质的量不变,所以原子数目等于3NA,故C错误;
D.V L 0.1mol/L的氯化铁溶液中,铁离子部分水解,溶液中铁离子数目减少,若Fe3+的数目为NA,则Cl-的数目大于3NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项B、C为易错点,注意合理分析题中数据.

练习册系列答案
相关题目
反应A(g)+3B(g)?2C(g)△h<0,在其他条件不变的情况下,下列说法正确的是( )
| A、加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B、增大压强,平衡正向移动,平衡常数增大 |
| C、当反应达平衡时,气体的平均相对分子质量不变 |
| D、升高温度,反应速率加快,反应放出的热量值增大 |
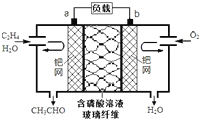 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、电子移动方向:电极a→磷酸溶液→电极b |
| C、正极反应式为:CH2=CH2-2e-+2OH-→CH3CHO+H2O |
| D、每有0.1mol O2反应,则迁移H+0.4mol |
雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是( )
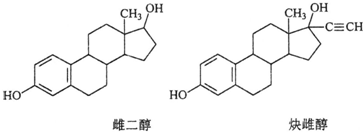

| A、核磁共振氢谱峰数相同 |
| B、均能发生加成反应、取代反应、消去反应 |
| C、两种分子中所有碳原子不可能在同一个平面内 |
| D、可用FeCl3溶液鉴别 |
解释下列事实的方程式不正确的是( )
| A、次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | ||
| B、硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | ||
| C、已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+
C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | ||
| D、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3?H2O |
下列说法正确的是( )
| A、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| B、能自发进行的化学反应,一定是△H<0、△S>0 |
| C、将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为氢氧化钠 |
| D、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
下列各组离子在水溶液中能大量共存的是( )
| A、Na+、Fe3+、I-、CO32- |
| B、K+、Fe2+、Cl-、NO3- |
| C、H+、Na+、SiO32-、CH3COO- |
| D、Ag+、K+、Br-、NO3- |
下列说法正确的是( )
| A、向1 mo1?L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | ||||||||||
B、25℃时,将a mol?L-l氨水与0.01mol?L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示反应完全时NH3?H2O的电离常数Kb=
| ||||||||||
C、根据表中数据可以计算出 (g)+3H2(g)→ (g)+3H2(g)→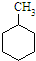 (g)的焓变 (g)的焓变
| ||||||||||
| D、已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001mol?L-1,c(CO32-)=0.0001mol?L-1,此时Mg2+和CO32-不能共存 |