题目内容
现有短周期元素组成的E五种物质,存在如图转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol电子,则B与浓盐酸反应的化学方程式为 ,生成的氧化产物与还原产物的物质的量之比为 ;
(2)固体C与水反应生成D的化学方程式为:
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式 ;若将浓度为c1的M溶液与0.2mol?L-1的一元酸HA等体积混合,所得溶液pH=7,则c1(填“≥”、“=”或“≤”)0.2mol?L-1,溶液中离子浓度的大小关系为 .

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol电子,则B与浓盐酸反应的化学方程式为
(2)固体C与水反应生成D的化学方程式为:
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式
考点:无机物的推断
专题:推断题
分析:短周期元素组成的A、B、C、D、E四种物质,C是淡黄色固体,与水反应生成无色气体D,故C为Na2O2,D为O2,E为黑色粉末,由A溶液
D可知,A为H2O2,E为MnO2,由固体B
D+F,结合(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1molB转移5mol电子,B中氯元素化合价为+5,则B为KClO3,F为KCl.
| E |
| E |
解答:
解:短周期元素组成的A、B、C、D四种物质,C是淡黄色固体,与水反应生成无色气体D,故C为Na2O2,D为O2,E为黑色粉末,由A溶液
D可知,A为H2O2,E为MnO2,由固体B
D+F,结合(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1molB转移5mol电子,B中氯元素化合价为+5,则B为KClO3,F为KCl,
(1)KClO3与浓盐酸反应生成氯化钾、氯气与水,反应方程式为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,反应中氧化产物与还原产物都是Cl2,氧化产物由HCl生成,还原产物由生成KClO3,由方程式可知起还原剂的HCl占参加反应的HCl的
,故氧化产物与还原产物的物质的量之比为6×
:1=5:1;
故答案为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,5:1;
(2)过氧化钠与水反应生成氢氧化钠与氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)电解KCl的饱和水溶液生成氢气、氯气、氢氧化钾,该反应的离子方程式:2Cl-+2H2O
H2↑+Cl2↑+2OH-;
若将浓度为c1 mol?L-1 的KOH溶液与0.2mol?L-1 的一元酸HA等体积混合,所得溶液pH=7,HA可能为强酸,也可能为弱酸,故c1≤0.2,溶液中c(OH-)=c(H+),由电荷守恒可知c(K+)=c(A-),溶液中离子浓度大小为:c(K+)=c(A-)>c(OH-)=c(H+);
故答案为:2Cl-+2H2O
H2↑+Cl2↑+2OH-;≤;c(K+)=c(A-)>c(OH-)=c(H+).
| E |
| E |
(1)KClO3与浓盐酸反应生成氯化钾、氯气与水,反应方程式为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,反应中氧化产物与还原产物都是Cl2,氧化产物由HCl生成,还原产物由生成KClO3,由方程式可知起还原剂的HCl占参加反应的HCl的
| 5 |
| 6 |
| 5 |
| 6 |
故答案为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,5:1;
(2)过氧化钠与水反应生成氢氧化钠与氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)电解KCl的饱和水溶液生成氢气、氯气、氢氧化钾,该反应的离子方程式:2Cl-+2H2O
| ||
若将浓度为c1 mol?L-1 的KOH溶液与0.2mol?L-1 的一元酸HA等体积混合,所得溶液pH=7,HA可能为强酸,也可能为弱酸,故c1≤0.2,溶液中c(OH-)=c(H+),由电荷守恒可知c(K+)=c(A-),溶液中离子浓度大小为:c(K+)=c(A-)>c(OH-)=c(H+);
故答案为:2Cl-+2H2O
| ||
点评:本题考查无机物推断,涉及实验室氧气制备、过氧化钠的性质、化学用语的书写等,C的颜色及特殊反应是推断突破口,再结合问题(1)进行推断,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、焊锡(锡铅合金)熔点比金属锡高 |
| B、油脂的皂化反应生成脂肪酸和甘油 |
| C、焰火的五彩缤纷是某些金属元素的性质的展现 |
| D、NaFeO4自身处理水的原理与明矾和漂白粉共同处理水的原理不同 |
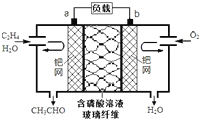 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、电子移动方向:电极a→磷酸溶液→电极b |
| C、正极反应式为:CH2=CH2-2e-+2OH-→CH3CHO+H2O |
| D、每有0.1mol O2反应,则迁移H+0.4mol |
解释下列事实的方程式不正确的是( )
| A、次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | ||
| B、硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | ||
| C、已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+
C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | ||
| D、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3?H2O |
下列装置的设计能达到实验目的是( )
A、 除去乙醇中的乙酸 |
B、 形成原电池 |
C、 分离水和四氯化碳 |
D、 干燥HI |
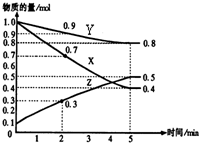 (1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为: