题目内容
用下列实验装置进行相应实验,设计正确且能达到实验目的是( )
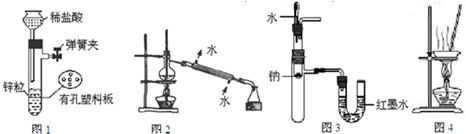

| A、用图1所示装置制取少量H2 |
| B、用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物 |
| C、用图3所示装置验证Na和水反应的热效应 |
| D、用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.图1为气体简易发生装置,可用于制备氢气,但不能用盐酸;
B.温度计水银球位置错误;
C.根据U形管两侧液面的变化可判断;
D.氯化铵不稳定,加热易分解.
B.温度计水银球位置错误;
C.根据U形管两侧液面的变化可判断;
D.氯化铵不稳定,加热易分解.
解答:
解:A.盐酸易挥发,应用稀硫酸制备氢气,故A错误;
B.蒸馏时,温度计水银球应位于蒸馏烧瓶的支管口附近,故B错误;
C.钠和水反应放热,试管内压强增大,可观察到U形管左侧液面下降,右侧液面升高,故C正确;
D.氯化铵不稳定,加热易分解,不能将溶液蒸干,故D错误.
故选C.
B.蒸馏时,温度计水银球应位于蒸馏烧瓶的支管口附近,故B错误;
C.钠和水反应放热,试管内压强增大,可观察到U形管左侧液面下降,右侧液面升高,故C正确;
D.氯化铵不稳定,加热易分解,不能将溶液蒸干,故D错误.
故选C.
点评:本题考查化学实验方案的评价,为高频考点,涉及气体的制备、物质的分离、反应的探究等,把握反应原理、物质性质及实验装置图的作用为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、苯中含有杂质苯酚,可用浓溴水来除杂 |
B、1mol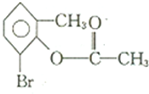 在一定条件下与足量NaOH溶液反应,最多消耗3mol NaOH 在一定条件下与足量NaOH溶液反应,最多消耗3mol NaOH |
C、按系统命名法,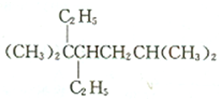 的名称为3,3,6一三甲基-4-乙基庚烷 的名称为3,3,6一三甲基-4-乙基庚烷 |
D、已知C-C键可以绕键轴自由旋转,结构简式为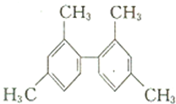 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 |
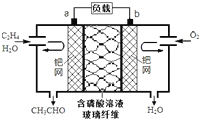 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、电子移动方向:电极a→磷酸溶液→电极b |
| C、正极反应式为:CH2=CH2-2e-+2OH-→CH3CHO+H2O |
| D、每有0.1mol O2反应,则迁移H+0.4mol |
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol Cl2参加的任何反应转移电子数都是2NA |
| B、标准状况下,22.4mL水中含有的分子数目约为1.24NA |
| C、常温常压下,29g乙基(-C2H5)所含电子数为13NA |
| D、0.1mol Na2O2中含有离子总数为0.4NA |
解释下列事实的方程式不正确的是( )
| A、次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | ||
| B、硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | ||
| C、已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+
C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | ||
| D、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3?H2O |
下列有关电化学的说法正确的是( )
| A、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| B、电解精炼铜时阴极发生还原反应 |
| C、用铜作电极电解后的硫酸铜溶液中,加入一定量的氧化铜即可恢复溶液的成分和浓度 |
| D、铜锌原电池工作时外电路电子由锌极流向铜极,内电路电子由铜极流向锌极 |
下列图示与对应叙述相符合的是( )
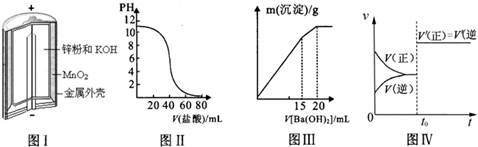

| A、图Ⅰ所示锌锰碱性电池正极的电极反应式为:MnO2+H2O+2e-═MnOOH+OH- |
| B、图Ⅱ表示盐酸滴加到0.1mol?L-1某碱溶液中得到的滴定曲线,由图Ⅱ可知二者恰 好中和时,所得溶液的pH>7 |
| C、图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液时,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时,沉淀全部是BaSO4 |
| D、图Ⅳ表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
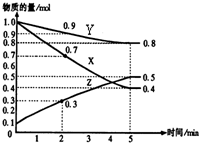 (1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为: