题目内容
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液不呈红色 | 稀HNO3不能将Fe氧化为Fe3+ |
| B | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和AgNO3溶液 | 均有固体析出 | 蛋白质均发生变性 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.过量的Fe粉中加入稀HNO3,生成硝酸亚铁;
B.向一定浓度的Na2SiO3溶液中通入适量CO2气体,生成硅酸沉淀,发生强酸制取弱酸的反应;
C.AgNO3溶液为重金属盐溶液,使蛋白质变性,而NaCl不能;
D.浓氨水中一水合氨电离生成氢氧根离子,且大于溶液中的氢离子浓度,溶液显碱性.
B.向一定浓度的Na2SiO3溶液中通入适量CO2气体,生成硅酸沉淀,发生强酸制取弱酸的反应;
C.AgNO3溶液为重金属盐溶液,使蛋白质变性,而NaCl不能;
D.浓氨水中一水合氨电离生成氢氧根离子,且大于溶液中的氢离子浓度,溶液显碱性.
解答:
解:A.过量的Fe粉中加入稀HNO3,生成硝酸亚铁,则滴入KSCN溶液不变色,但稀HNO3能将Fe氧化为Fe3+,过量Fe与Fe3+反应,故A错误;
B.向一定浓度的Na2SiO3溶液中通入适量CO2气体,生成硅酸沉淀,发生强酸制取弱酸的反应,则H2SiO3的酸性比H2CO3的酸性弱,故B错误;
C.AgNO3溶液为重金属盐溶液,使蛋白质变性,而NaCl不能,NaCl溶液使蛋白质发生盐析,故C错误;
D.浓氨水中一水合氨电离生成氢氧根离子,且大于溶液中的氢离子浓度,溶液显碱性,则用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝,故D正确;
故选D.
B.向一定浓度的Na2SiO3溶液中通入适量CO2气体,生成硅酸沉淀,发生强酸制取弱酸的反应,则H2SiO3的酸性比H2CO3的酸性弱,故B错误;
C.AgNO3溶液为重金属盐溶液,使蛋白质变性,而NaCl不能,NaCl溶液使蛋白质发生盐析,故C错误;
D.浓氨水中一水合氨电离生成氢氧根离子,且大于溶液中的氢离子浓度,溶液显碱性,则用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝,故D正确;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,把握氧化还原反应、酸性的比较、蛋白质的性质及氨水的性质即可解答,注意实验的评价性、操作性分析,侧重物质性质及实验技能的考查,题目难度不大.

练习册系列答案
相关题目
解释下列事实的方程式不正确的是( )
| A、次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | ||
| B、硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | ||
| C、已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+
C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | ||
| D、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3?H2O |
下列有关电化学的说法正确的是( )
| A、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| B、电解精炼铜时阴极发生还原反应 |
| C、用铜作电极电解后的硫酸铜溶液中,加入一定量的氧化铜即可恢复溶液的成分和浓度 |
| D、铜锌原电池工作时外电路电子由锌极流向铜极,内电路电子由铜极流向锌极 |
下列各组离子在水溶液中能大量共存的是( )
| A、Na+、Fe3+、I-、CO32- |
| B、K+、Fe2+、Cl-、NO3- |
| C、H+、Na+、SiO32-、CH3COO- |
| D、Ag+、K+、Br-、NO3- |
下列装置的设计能达到实验目的是( )
A、 除去乙醇中的乙酸 |
B、 形成原电池 |
C、 分离水和四氯化碳 |
D、 干燥HI |
下列图示与对应叙述相符合的是( )
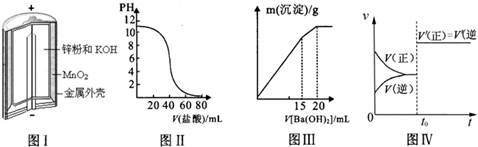

| A、图Ⅰ所示锌锰碱性电池正极的电极反应式为:MnO2+H2O+2e-═MnOOH+OH- |
| B、图Ⅱ表示盐酸滴加到0.1mol?L-1某碱溶液中得到的滴定曲线,由图Ⅱ可知二者恰 好中和时,所得溶液的pH>7 |
| C、图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液时,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时,沉淀全部是BaSO4 |
| D、图Ⅳ表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
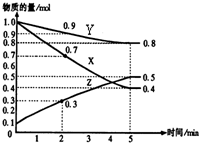 (1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为: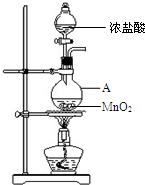 研究小组用下图装置制取Cl2,证明产生的气体中含有HCl.
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl.