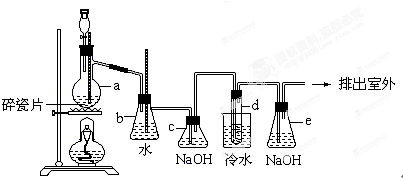
题目内容
20.下表是现行的元素周期表,请按题中要求回答下列有关问题:| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||||||||
| ⑪ | ⑫ | ||||||||||||||||
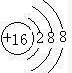
(2)画出⑨的简单离子的结构示意图
 .
.(3)①②⑤⑧的原子半径由大到小的顺序是Na>Si>C>H(用元素符号表示).
(4)②⑧⑨⑩的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3>H2SiO3(用化学式表示).
(5)⑤与⑦的最高价氧化物的水化物间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑨⑩的简单离子半径由大到小的顺序是S2->Cl-(用离子符号表示).
(7)⑩的非金属性比⑫强,用一个离子方程式表示为2Br-+Cl2=2Cl-+Br2.
(8)用电子式表示⑨与⑪形成化合物的过程为
 .
.(9)③的气态氢化物与其最高价含氧酸反应的产物中化学键的类型是离子键和共价键.
(10)⑥与⑦的金属性较强的是镁(填元素名称).
(11)②的最高价氧化物的电子式为
 .
.
分析 由元素在周期表的位置可知,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为S、⑩为Cl、⑪为K、⑫为Br;
(1)第七周期稀有气体原子序数=86+32=118,是第七周期最后一种元素,位于18列;
(2)S的简单离子中质子数为16,核外电子为18;
(3)电子层越多,原子半径越大;同周期从左向右原子半径减小;
(4)非金属性越强,对应最高价氧化物的水化物的酸性越强;
(5)⑤与⑦的最高价氧化物的水化物反应生成偏铝酸钠和水;
(6)⑨⑩的简单离子具有相同电子排布,原子序数大的离子半径小;
(7)⑩的非金属性比⑫强,由卤素单质之间的置换反应可说明;
(8)⑨与⑪形成化合物为K2S;
(9)③的气态氢化物与其最高价含氧酸反应的产物为硝酸铵;
(10)同周期,原子序数大的金属性弱;
(11)②的最高价氧化物为CO2,以此来解答.
解答 解:由元素在周期表的位置可知,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为S、⑩为Cl、⑪为K、⑫为Br;
(1)第七周期稀有气体原子序数=86+32=118,是第七周期最后一种元素,位于18列,115号元素处于第15列,故115号元素位于第七周期第ⅤA族,
故答案为:第七周期第ⅤA族;
(2)S的简单离子中质子数为16,核外电子为18,离子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)电子层越多,原子半径越大;同周期从左向右原子半径减小,则原子半径为Na>Si>C>H,故答案为:Na>Si>C>H;
(4)非金属性越强,对应最高价氧化物的水化物的酸性越强,则酸性为HClO4>H2SO4>H2CO3>H2SiO3,故答案为:HClO4>H2SO4>H2CO3>H2SiO3;
(5)⑤与⑦的最高价氧化物的水化物反应生成偏铝酸钠和水,离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(6)⑨⑩的简单离子具有相同电子排布,原子序数大的离子半径小,则离子半径为S2->Cl-,故答案为:S2->Cl-;
(7)⑩的非金属性比⑫强,由卤素单质之间的置换反应可说明,如2Br-+Cl2=2Cl-+Br2,故答案为:2Br-+Cl2=2Cl-+Br2;
(8)⑨与⑪形成化合物为K2S,用电子式表示形成化合物的过程为 ,
,
故答案为: ;
;
(9)③的气态氢化物与其最高价含氧酸反应的产物为硝酸铵,含离子键和共价键,故答案为:离子键和共价键;
(10)同周期,原子序数大的金属性弱,则⑥与⑦的金属性较强的是镁,故答案为:镁;
(11)②的最高价氧化物为CO2,其电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

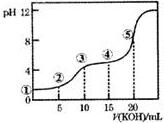 常温下,用0.10mol•L-1的KOH标准溶液滴定10.00mL0.10mol•L-1的H2C2O4(二元弱酸)溶液所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1的KOH标准溶液滴定10.00mL0.10mol•L-1的H2C2O4(二元弱酸)溶液所得滴定曲线如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)/c(OH-)=1012 | |
| B. | 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| C. | 点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol•L-1 | |
| D. | 点⑤所示溶液中:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) |
| A. | 该混合溶液中有:c(Na+)+c(H+)=c(HC2O4-)+c (OH-)+2 c (C2O42-) | |
| B. | 该混合溶液中有:c (Na+)=2 (c(HC2O4-)+c (H2C2O4)+c (C2O42-)) | |
| C. | 该混合溶液中有:c (OH-)-c(H+)=c(HC2O4-)+2 c (H2C2O4) | |
| D. | 该混合溶液中有:c (Na+)>c (C2O42-)>c(HC2O4-)>c (OH-)>c(H+) |
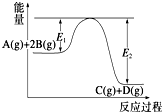
| A. | 该反应为放热反应 | |
| B. | 当反应达到平衡时,降低温度,A的转化率增大 | |
| C. | 升高温度,平衡常数K减小;压强增大,平衡向正反应方向移动 | |
| D. | 加入催化剂,反应速率增大,E1减小,E2减小,反应热减小 |
| A. | 加入苛性钠溶液 | B. | 用水湿润 | C. | 加少量盐酸 | D. | 加干燥剂使用 |
| A. | NH3 | B. | PCl3 | C. | PCl5 | D. | BCl3 |