题目内容
5.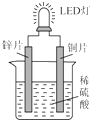 如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )
如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )| A. | 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生 | |
| B. | 如果将锌片换成铁片,电路中的电流方向将改变 | |
| C. | 其能量转化的形式主要是“化学能→电能→光能” | |
| D. | 如果将稀硫酸换成柠檬汁,LED灯将不会发光 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,正极发生还原反应生成氢气,以此解答该题.
解答 解:A.锌片作负极,发生氧化反应;铜片作正极,发生还原反应,铜片上有气泡产生,故A错误;
B.如果将锌片换成铁片,铁片依然是作负极,电路中的电流方向不会发生改变,故B错误;
C.其能量转化的形式主要是“化学能→电能→光能”,故C正确;
D.如果将稀硫酸换成柠檬汁,由于柠檬汁中含有柠檬酸,溶液呈酸性,LED灯也会发光,故D错误;
故选C.
点评 本题考查了原电池原理,明确正负极的判断方法以及能量的转化即可解答,可以从电子流向、电极上得失电子、电极上发生反应类型来判断正负极,难度不大.

练习册系列答案
相关题目
15.某可逆反应正向反应过程中能量变化如图所示,下列说法不正确的是( )
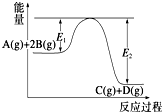

| A. | 该反应为放热反应 | |
| B. | 当反应达到平衡时,降低温度,A的转化率增大 | |
| C. | 升高温度,平衡常数K减小;压强增大,平衡向正反应方向移动 | |
| D. | 加入催化剂,反应速率增大,E1减小,E2减小,反应热减小 |
13.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和H2O(g),已知:
N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是( )
N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-1059.3 kJ/mol | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g);△H=-1076.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-1076.7 kJ/mol |
20.下列说法正确的是( )
| A. | SiO2与所有的酸都不能发生反应 | |
| B. | 将CO2、SO2通入Ca(ClO)2溶液均发生反应且反应类型相同 | |
| C. | 过量的铜与浓硝酸反应能生成NO气体 | |
| D. | 加盐酸产生能使澄清石灰水变浑浊气体的钠盐为Na2CO3 |
10.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | NH3 | B. | PCl3 | C. | PCl5 | D. | BCl3 |
17.历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是( )
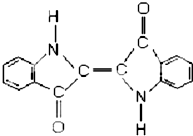

| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是 C16H10N2O2 | ||
| C. | 该物质是苯的同系物 | D. | 它含有碳碳双键、羰基等官能团 |
14.燃烧1g乙醇(液态)生成CO2气体和液态水放出热量为29.7KJ,则乙醇燃烧的热化学方程式正确的是( )
| A. | C2H5OH+3O2═2CO2+3H2O△H=-29.7 kJ/mol | |
| B. | C2H5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=-1366.2kJ/mol | |
| C. | C2 H5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol | |
| D. | C2H5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol |
15.从2015年1月1日起我国施行新的《环境保护法》.下列做法不应该提倡的是( )
| A. | 将煤汽化和液化,得到清洁的燃料和化工原料 | |
| B. | 用CO2合成聚碳酸酯等可降解塑料,减少白色污染 | |
| C. | 加强生活污水的脱氮除磷的处理,遏制水体富营养化 | |
| D. | 研究采煤、采油新技术,尽量提高其产量以满足工业生产快速发展的需求 |