题目内容
20.下列实验方法或装置正确的是( )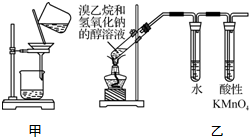
| A. | 用玻璃棒蘸取氯水点在干燥的pH试纸上,测定该溶液的pH | |
| B. | 称取4.0 g NaOH,放入100 mL容量瓶中,加水稀释,配制1.0 mol•L-1的NaOH溶液 | |
| C. | 用甲装置分离Cl2与KI溶液反应生成的碘 | |
| D. | 用乙装置检验溴乙烷与NaOH醇溶液共热产生乙烯 |
分析 A.氯水中HClO具有漂白性;
B.不能在容量瓶中溶解;
C.Cl2与KI溶液反应生成的碘,溶于水;
D.发生消去反应生成乙烯,水可除去乙醇.
解答 解:A.氯水中HClO具有漂白性,不能利用pH试纸测定,则利用pH计,故A错误;
B.不能在容量瓶中溶解,应在烧杯中溶解、冷却后转移,故B错误;
C.Cl2与KI溶液反应生成的碘,溶于水,不能过滤分离,故C错误;
D.发生消去反应生成乙烯,水可除去乙醇,装置可检验溴乙烷与NaOH醇溶液共热产生乙烯,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、溶液配制、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
10.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | NH3 | B. | PCl3 | C. | PCl5 | D. | BCl3 |
11.在一定温度下,密闭容器中可逆反应N2(g)+3H2(g)?2NH3(g)达到平衡的标志是( )
| A. | 混合气体的密度不再发生变化 | |
| B. | 单位时间内生成nmolN2的同时生成3nmolH2 | |
| C. | N2、H2、NH3的浓度不再发生变化 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
8.下列化学实验事实及其解释或结论都正确的是( )
| A. | 测定同温度下相同浓度的Na2CO3和Na2SO3溶液的pH,前者大于后者,说明碳元素非金属性弱于硫元素 | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 往苯酚的浊液中加入Na2CO3溶液,溶液变澄清,说明酸性:苯酚>HCO3- | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
15.从2015年1月1日起我国施行新的《环境保护法》.下列做法不应该提倡的是( )
| A. | 将煤汽化和液化,得到清洁的燃料和化工原料 | |
| B. | 用CO2合成聚碳酸酯等可降解塑料,减少白色污染 | |
| C. | 加强生活污水的脱氮除磷的处理,遏制水体富营养化 | |
| D. | 研究采煤、采油新技术,尽量提高其产量以满足工业生产快速发展的需求 |
5.常温下,下列有关叙述正确的是( )
| A. | 0.1 mol•L-1氨水中c$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,则c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 在0.1 mol•L-1(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)] | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合:c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |

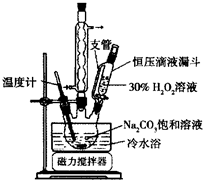 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.