题目内容
11.下列离子方程式书写正确的是( )| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 钠与水的反应Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O | |
| D. | 铝片和氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
分析 A.氢氧化钠过量,二者反应生成碳酸钙、碳酸钠和水;
B.电荷不守恒;
C.电荷不守恒;
D.二者反应生成偏铝酸钠和氢气.
解答 解:A.碳酸氢钙溶液中加入过量的氢氧化钠溶液,离子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故A错误;
B.钠与水的反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.铜片跟稀硝酸反应,离子方程式:2Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故C错误;
D.铝片和氢氧化钠溶液反应,离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,侧重考查复分解、氧化还原反应的离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,题目难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
19.如图表示在常温下CH3COOH溶液中加水时溶液的导电性变化,下列叙述不正确的是( )


| A. | a点:c(H+)>c(CH3COO-)>c(OHˉ) | |
| B. | b点:c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 已知常温下,物质的量浓度相等的CH3COONa与CH3COOH混合液的pH<7,在此溶液中继续加CH3COONa至pH=7,则此时溶液中存在:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) | |
| D. | CH3COOH溶液的pH:a>b |
16.有如图反应:mA(g)?nB(g),当加压后,反应速率如图所示,推断系数m和n的关系是( )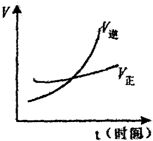

| A. | m>n | B. | m<n | C. | m=n | D. | 无法确定 |
3.下列各组多电子原子的原子轨道能量高低比较中,错误的是( )
| A. | 3px<3py | B. | 2s<2p | C. | 3s<3d | D. | 4s>3p |
2.甲、乙、丙为中学化学常见物质,它们有如下转化关系.其中不能实现的一组是D


| 甲 | 乙 | 丙 | |
| A | Na2CO3 | NaHCO3 | CO2 |
| B | Mg(OH)2 | MgCO3 | CO2 |
| C | NaAlO2 | Al(OH)3 | AlCl3 |
| D | Al(OH)3 | Al | AlCl3 |

 ,C→D的反应类型为取代反应.
,C→D的反应类型为取代反应. 或
或 .
. 、
、 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).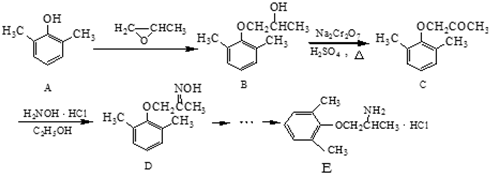
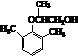 .
. .
.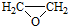 ).
).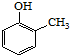 )和乙醇为原料制备
)和乙醇为原料制备 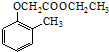 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用). ,食醋中的有机物结构式
,食醋中的有机物结构式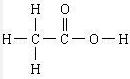 ,乙烯水化法所得产物的结构简式CH3CH2OH.
,乙烯水化法所得产物的结构简式CH3CH2OH.
 F
F
 ④
④
 .
.