题目内容
19.如图表示在常温下CH3COOH溶液中加水时溶液的导电性变化,下列叙述不正确的是( )
| A. | a点:c(H+)>c(CH3COO-)>c(OHˉ) | |
| B. | b点:c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 已知常温下,物质的量浓度相等的CH3COONa与CH3COOH混合液的pH<7,在此溶液中继续加CH3COONa至pH=7,则此时溶液中存在:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) | |
| D. | CH3COOH溶液的pH:a>b |
分析 A、a点CH3COOH溶液的电离,CH3COOH?CH3COO-+H+,溶剂水的电离产生氢离子;
B、电荷守恒分析解答;
C、根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),而溶液呈中性,所以c(H+)=c(OH-);
D、b点氢离子浓度小于a点氢离子的浓度.
解答 解:A、a点CH3COOH溶液的电离,CH3COOH?CH3COO-+H+,溶剂水的电离产生氢离子,所以离子浓度大小的顺序为:c(H+)>c(CH3COO-)>c(OHˉ),故A正确;
B、b点电荷守恒:c(H+)=c(CH3COO-)+c(OH-),故B正确;
C、根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),而溶液呈中性,所以c(H+)=c(OH-),所以溶液中存在:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故C正确;
D、b点氢离子浓度小于a点氢离子的浓度,所以CH3COOH溶液的pH:a<b,故D错误;
故选D.
点评 本题考查了酸碱混合时溶液定性判断及有关pH的简单计算,题目难度中等,注意掌握根据电荷守恒、物料守恒比较溶液中离子浓度定性关系的方法.注意过程的分析.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
9.下列各组物理量中,都不随取水量的变化而变化的是( )
| A. | 水的沸点;蒸发水所需热量 | |
| B. | 水的密度;水中通入足量CO2后溶液的pH | |
| C. | 水的体积;电解水所消耗的电量 | |
| D. | 水的物质的量;水的摩尔质量 |
7.下列变化必须加入还原剂才能实现的是( )
| A. | Cu→Cu2(OH)CO3 | B. | HCl→Cl2 | C. | Fe2O3→Fe | D. | Al(OH)3→Al2O3 |
14.在短周期中X、Y可形成化合物XY3,下列叙述错误的是( )
| A. | 若Y的原子序数为m,则X的原子序数可能为m+4 | |
| B. | XY3可能是离子化合物 | |
| C. | X、Y可能同周期,也可能同主族 | |
| D. | XY3可能是原子晶体 |
11.下列离子方程式书写正确的是( )
| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 钠与水的反应Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O | |
| D. | 铝片和氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
11.下列反应中,不属于氧化还原反应的是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | H2+Cl2═2HCl | ||
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | D. | Fe+CuSO4═FeSO4+Cu |
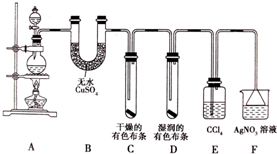 某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):
某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):