题目内容
1.向100mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热.下列有关分析正确的是( )| A. | 所得液体属于纯净物 | B. | 该红褐色液体能产生了达尔效应 | ||
| C. | 所得液体中分散质粒子只有Fe(OH)3 | D. | 上述实验过程中没有发生化学变化 |
分析 向100mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,得到Fe(OH)3胶体,方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,胶体粒子是大量氢氧化铁的聚集体,根据胶体的性质解答;
解答 解:向100mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,得到Fe(OH)3胶体,
A、胶体中含有分散质、分散剂,属于混合物,故A错误;
B、胶体具有丁达尔效应,当用激光笔照射时,会有一道明亮的光路,故B正确;
C、胶体粒子是大量氢氧化铁的聚集体,不是只有Fe(OH)3,故C错误;
D、上述实验过程中发生化学反应:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,故D错误;
故选B.
点评 本题考查了胶体的制备和胶体的性质,易错点为胶体的制备,注意制备方法.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
12.已知在25℃、101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(g)△H=-48.40 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=+5518 kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-48.40 kJ•mol-1 |
6.重结晶的主要成分是BaSO4,用重晶石制备Ba(OH)2•8H2O的主要过程如图所示.下列分析错误的是( )
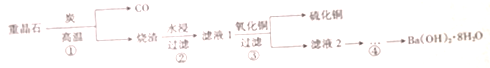

| A. | 步骤①中BaSO4作氧化剂 | |
| B. | 步骤②所得滤液1呈中性 | |
| C. | 步骤③中发生复分解反应 | |
| D. | 步骤④的实验操作中不需要用到石棉网、坩埚 |
13.分子式为 C5H10O2 并能与饱和 NaHCO3 溶液反应放出气体的有机物有 (不含立体异构)( )
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
11.下列说法正确的是( )
| A. | SO2能使溴水褪色,这表现了SO2的漂白性 | |
| B. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| C. | 氨的水溶液能导电,所以氨是强电解质 | |
| D. | 按a、b两种途径制备等量的硝酸镁,消耗的二种酸的物质的量不同 途径a:Mg$→_{△}^{O_{2}}$MgO$\stackrel{稀硝酸}{→}$Mg(NO3)2 途径b:Mg$\stackrel{浓硫酸}{→}$MgSO4$\stackrel{Ba(NO_{3})_{2}溶液}{→}$Mg(NO3)2 |
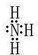 ;
;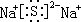 .
.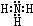 ,B的结构式为
,B的结构式为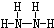 .
. .
.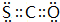 .
.