题目内容
6.重结晶的主要成分是BaSO4,用重晶石制备Ba(OH)2•8H2O的主要过程如图所示.下列分析错误的是( )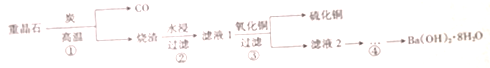
| A. | 步骤①中BaSO4作氧化剂 | |
| B. | 步骤②所得滤液1呈中性 | |
| C. | 步骤③中发生复分解反应 | |
| D. | 步骤④的实验操作中不需要用到石棉网、坩埚 |
分析 重结晶的主要成分是BaSO4,用重晶石制备Ba(OH)2•8H2O的主要过程为:反应①是BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s),烧渣主要为BaS,步骤 ②水浸过滤得滤液1为BaS溶液,步骤③为用氧化铜与硫化钡溶液反应生成硫化铜,反应方程式为BaS+CuO+H2O=CuS↓+Ba(OH)2,得滤液2为氢氧化钡溶液,经步骤④蒸发浓缩、冷却结晶得Ba(OH)2•8H2O,据此答题.
解答 解:重结晶的主要成分是BaSO4,用重晶石制备Ba(OH)2•8H2O的主要过程为:反应①是BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s),烧渣主要为BaS,步骤 ②水浸过滤得滤液1为BaS溶液,步骤③为用氧化铜与硫化钡溶液反应生成硫化铜,反应方程式为BaS+CuO+H2O=CuS↓+Ba(OH)2,得滤液2为氢氧化钡溶液,经步骤④蒸发浓缩、冷却结晶得Ba(OH)2•8H2O,
A、根据反应BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)可知,BaSO4作氧化剂,故A正确;
B、滤液1为BaS溶液,是强碱弱酸盐,水解溶液呈碱性,故B错误;
C、步骤③为用氧化铜与硫化钡溶液反应生成硫化铜,反应方程式为BaS+CuO+H2O=CuS↓+Ba(OH)2,是复分解反应,故C正确;
D、步骤④的实验操作为蒸发,所以不需要用到石棉网、坩埚,故D正确,
故选B.
点评 本题考查了物质制备、分离和提纯的方法和基本操作综合应用,主要是分离提纯的方法、物质性质的分析应用等知识,掌握基础是解题关键,题目难度中等.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案| A. | 在25℃和80℃时纯水中的c(H+)浓度 | |
| B. | 室温时,浓度均为 0.1mol/L的(NH4)2SO4(aq)、(NH4)2CO3 (aq)的c(NH4+) | |
| C. | 25℃时,pH均为3的HCl和NH4Cl溶液中水的电离程度 | |
| D. | 1 L饱和氯化铵溶液中NH4+ 和Cl- 的个数 |
| A. | 所得液体属于纯净物 | B. | 该红褐色液体能产生了达尔效应 | ||
| C. | 所得液体中分散质粒子只有Fe(OH)3 | D. | 上述实验过程中没有发生化学变化 |
| A. | CH4 | B. | C2H4 | C. | C4H6 | D. | C6H6 |
| A. | 5mol/L 氢硫酸溶液 | B. | 18.4mol/L 盐酸溶液 | ||
| C. | 含甲醛40%的福尔马林溶液 | D. | 含乙酸12%的食醋溶液 |
| A. | 铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H+═2Fe3++3H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
 ,D原子的原子结构示意图为
,D原子的原子结构示意图为 ,C+离子的结构示意图为
,C+离子的结构示意图为 .
.
 .
.