题目内容
9.有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.①A元素最外层电子数是次外层电子数的2倍.②B的阴离子和C的阳离子与氖原子的电子层结构相同.③在通常状况下,B的单质是气体,0.1mol B的气体与足量的氢气完全反应共有0.4mol电子转移.④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质.⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应.请写出:(1)A元素的最高价氧化物的结构式O=C=O;B元素在周期表中的位置第二周期第ⅥA族.
(2)C单质在B单质中燃烧的生成物中所含化学键类型有离子键、非极性共价键(或共价键);C与D 能形成化合物的电子式
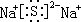 .
.(3)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(4)元素D与元素E相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd(填选项序号).
a.常温下D的单质和E的单质状态不同 b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应 d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质.
分析 有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.A的最外层电子数是次外层电子数的2倍,则A原子有2个电子层,最外层电子数为4,则A为碳元素;B的阴离子和C的阳离子与氖原子的电子层结构相同,则C处于第三周期、B处于第二周期,在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移,B元素表现-2价,则B为O元素;C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质,则C为Na;D的气态氢化物与其最高价含氧酸间能发生氧化还原反应,E的原子序数最大,则D为S元素,E为Cl,以此来解答.
解答 解:有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.A的最外层电子数是次外层电子数的2倍,则A原子有2个电子层,最外层电子数为4,则A为碳元素;B的阴离子和C的阳离子与氖原子的电子层结构相同,则C处于第三周期、B处于第二周期,在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移,B元素表现-2价,则B为O元素;C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质,则C为Na;D的气态氢化物与其最高价含氧酸间能发生氧化还原反应,E的原子序数最大,则D为S元素,E为Cl.则
(1)A为碳元素,最高价氧化物为CO2,结构式为O=C=O;B为氧元素,在周期表中的位置是第二周期VIA族,
故答案为:O=C=O;第二周期VIA族;
(2)B单质与C单质在点燃时反应的生成物为Na2O2,含有离子键、共价键;C与D 能形成化合物是硫化钠,含离子键,则电子式为 ,
,
故答案为:离子键、非极性共价键(或共价键); ;
;
(3)D元素的低价氧化物为二氧化硫,与氯气的水溶液反应的离子方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)同周期自左而右元素非金属性增强,故非金属性Cl>S,
a.单质状态属于物理性质,不能比较元素非金属性,故a错误;
b.氢化物稳定性与元素非金属性一致,氯化氢比硫化氢稳定,说明氯的非金属性更强,故b正确;
c.与变价金属反应可以根据产物中金属化合价判断非金属元素的非金属性强弱,Na不是变价金属,不能判断硫与氯的非金属性强弱,故c错误;
d.最高价含氧酸的酸性与中心元素的非金属性一致,故d正确;
e.硫不能与HCl反应生成氯气,故e错误;
故答案为:Cl;bd.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意过氧化钠的性质及应用,题目难度不大.

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案| A. | 用肥皂洗涤久置石灰水的试剂瓶 | B. | 用酒精清洗残留碘的试管 | ||
| C. | 用洗涤剂清洗餐具上的油污 | D. | 用汽油清洗沾在手上的油漆 |
| A. | 若a<b,则c(OH-)<c(H+) | B. | 若a>b,则c(NH4+)>c(Cl-) | ||
| C. | 若a>b,则c(OH-)>c(H+) | D. | 若a=b,则c(NH4+)=c(Cl-) |
| A. | 所得液体属于纯净物 | B. | 该红褐色液体能产生了达尔效应 | ||
| C. | 所得液体中分散质粒子只有Fe(OH)3 | D. | 上述实验过程中没有发生化学变化 |
| A. | 0.05 mol液态KHSO4中含有0.05 NA个阳离子 | |
| B. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA | |
| C. | 常温下,100 mL 1 mol•L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA |
 元素在周期表中的位置,反映了元素的原子结构和元素性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素性质.如图是元素周期表的一部分. ,D原子的原子结构示意图为
,D原子的原子结构示意图为 ,C+离子的结构示意图为
,C+离子的结构示意图为 .
.
 .
.