题目内容
17. 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.①提出假设:
假设1:只存在Fe2O3;假设2:只存在Cu2O;假设3:既存在Fe2O3也存在Cu2O.
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+═Cu+Cu2++H2O.
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体.由此可得出假设Cu2O不成立,写出产生上述气体的化学方程式Cu2O+6HNO3(浓)═2Cu(NO3)2+2NO2↑+3H2O.
步骤二:取少量步骤一溶液置于试管中滴加KSCN溶液,振荡,若溶液显红色,则说明假设3成立.
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设_不成立.
方案三:(如图)
同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数.
讨论分析:该实验方案能(填“能”或“不能”)测出矿物中Fe2O3的质量分数.不改变装置和药品,通过计算得出矿物中Fe2O3的质量分数,你还可以通过测定测量反应后固体的质量或广口瓶中沉淀的质量.若测得m1为3.04g,m3=m2+1.76g,则原样品中Fe2O3的质量分数为70.18%(结果保留四位有效数字).
分析 ①某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,依据提出假设分析:
③方案一:
步骤一:样品可能含有Fe2O3和Cu2O中的一种或两种,依据Cu2O在酸性溶液中会发生反应:Cu2O+2H+═Cu+Cu2++H2O分析可知,加入过量浓硝酸,产生一种红棕色的气体说明有还原硝酸的物质只有氧化铁无此性质,判断一定含有Cu2O,氧化亚铜和浓硝酸反应生成硝酸铜,二氧化氮和水;
步骤二:假设3可以利用氧化铁溶于酸生成铁离子,用KSCN溶液检验;
方案二:取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设2:只存在Fe2O3不成立;
方案三:石灰水不一定能将生成的二氧化碳全部吸收,而且从装置可以看出,石灰水直接与空气接触,可能吸收空气中的二氧化碳;
要测定矿物中Fe2O3的质量分数,可以根据生成的二氧化碳的质量或是反应前后固体物质的质量差来进行计算.
解答 解:①某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,假设1:只存在Fe2O3;假设2:只存在Cu2O;假设3:既存在Fe2O3也存在Cu2O.
故答案为:只存在Cu2O;
③方案一:
步骤一:样品可能含有Fe2O3和Cu2O中的一种或两种,依据Cu2O在酸性溶液中会发生反应:Cu2O+2H+═Cu+Cu2++H2O分析可知,加入过量浓硝酸,产生一种红棕色的气体说明有还原硝酸的物质只有氧化铁无此性质,判断一定含有Cu2O,氧化亚铜和浓硝酸反应生成硝酸铜,二氧化氮和水,反应的化学方程式为:Cu2O+6HNO3(浓)═2Cu(NO3)2+2NO2↑+3H2O,
故答案为:Cu2O;Cu2O+6HNO3(浓)═2Cu(NO3)2+2NO2↑+3H2O;
步骤二:假设3:既存在Fe2O3也存在Cu2O,取少量步骤一溶液置于试管中滴加KSCN溶液,振荡,若溶液显红色则说明假设3成立,
故答案为:KSCN溶液;溶液显红色;
方案二:取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,
假设1:只存在Fe2O3可以全部溶解,
假设2:只存在Cu2O,在硫酸溶液中发生反应:Cu2O+2H+═Cu+Cu2++H2O,一定有固体生成,
假设3:既存在Fe2O3也存在Cu2O,加入过量硫酸,氧化亚铜溶于硫酸生成硫酸铜、铜单质,氧化铁溶解得到铁离子,铁离子可以溶解金属铜,可以无剩余固体,
说明假设2只存在Cu2O不成立,
故答案为:2;
方案三:石灰水是氢氧化钙的水溶液,氢氧化钙是微溶于水的物质,故所含的溶质少,不一定能将生成的二氧化碳全部吸收,而且从装置可以看出,石灰水直接与空气接触,可能吸收空气中的二氧化碳,所以不一定能准确测出矿物中Fe2O3的质量分数,该实验方案可能测出矿物中Fe2O3的质量分数还可以设计实验通过测定反应前后固体物质的质量差测量反应后固体的质量或广口瓶中沉淀的质量进行计算,
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
若测得m1为3.04g,m3=m2+1.76g,m3-m2=1.76g为生成二氧化碳气体质量,结合化学方程式定量关系计算,3CO+Fe2O3=3CO2+2Fe
则原样品中Fe2O3的质量分数=$\frac{\frac{1.76g}{44g/mol}×\frac{1}{3}×160g/mol}{3.04g}$×100%=70.18%,
故答案为:能;测量反应后固体的质量或广口瓶中沉淀的质量;70.18%.
点评 本题考查了物质组成、物质含量的测定、物质性质和检验,主要是实验过程分析和定量计算,掌握基础是解题关键,题目难度中等.

| A. | 该反应中Na2O2既是氧化剂又是还原剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 1mol Na2O2发生反应,有2mol电子转移 | |
| D. | 在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌 |
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 4.7 | 3.4 |
| 沉淀完全的pH | 3.2 | 6.7 | 4.7 |
| A. | 该温度下Ksp[Fe(OH)3]=1×10-14.6 | |
| B. | W主要含有 Cu(OH)2和Al(OH)3 | |
| C. | 溶液X中一定含有Cu2+、Fe3+和SO42- | |
| D. | 取溶液Y进行焰色反应,可判断溶液X中是否含有Na+ |
| A | B | ||
| D | E | G | J |
| L | M | Q |
(2)G2J2常用作橡胶的低温硫化剂和黏结剂,其电子式为
 .写出一个能表示元素G、J非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓或Na2S+Cl2=2NaCl+S↓.
.写出一个能表示元素G、J非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓或Na2S+Cl2=2NaCl+S↓.(3)G单质在空气中燃烧生成一种无色有刺激性气味的气体,该无色有刺激性气味的气体与含1molJ的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在-定条件下反应,可生成一种强酸和一种氧化物,且该反应中有NA个电子转移,则该反应的化学方程式是SO2+2HClO3$\frac{\underline{\;一定条件\;}}{\;}$H2SO4+2ClO2.
(4)A的最简单氢化物是极性(填“极性”或“非极性”)分子,实验室制备该物质的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O或NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(5)根据元素周期律,可以推测上表中长周期元素的单质具有半导体特性的是Ge、As(填元素符号).
 已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.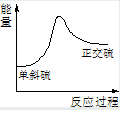
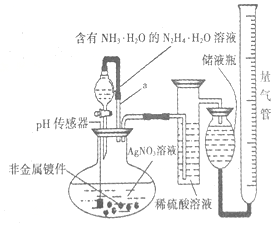 化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):
化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略): .已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.
.已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.