题目内容
6.HCl、CS2、H2S、SO2 4种分子中的非极性分子是CS2.分析 以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子,以此解答该题.
解答 解:HCl、CS2、H2S、SO2 4种分子都含有极性键,其中只有CS2结构对称,正负电荷的重心重合,电荷分布均匀,则CS2为含有极性键的非极性分子,
故答案为:CS2.
点评 本题考查化学键及分子的极性,把握化学键的判断规律及分子的空间构型为解答的关键,注意利用分子构型判断结构的对称性,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
11.下列有关苯的性质说法的是( )
| A. | 苯能使溴水褪色是因为苯与溴水发生了化学反应 | |
| B. | 欲从碘的苯溶液中分离出碘,通常采用萃取法 | |
| C. | 苯和不溶于水且密度比水大的四氯化碳都是无色液体,用试管和水就可以区别它们 | |
| D. | 因为苯通常是无色液体,所以在0℃的环境中可以直接将苯从试剂瓶倒人试管中 |
14.下列能正确表示水解反应离子方程式的是( )
| A. | HCO3-+H2O?CO32-+H3O+ | B. | HCO3-+OH-?CO32-+H2O | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | S2-+2H2O?H2S+2OH- |
11.下列化合物中,既存在离子键又存在共价键的是( )
| A. | 硫酸钠 | B. | 乙酸 | C. | 氯化镁 | D. | 二氧化碳 |
18.下列关于浓硫酸和稀硫酸的叙述中错误的是( )
| A. | 都能作干燥剂 | B. | 都具有一定的氧化性 | ||
| C. | 加热时都能与铜发生反应 | D. | 在常温下都能用铁制容器贮存 |
16.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 酒精能使蛋白质变性,可用于杀菌消毒 |
 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.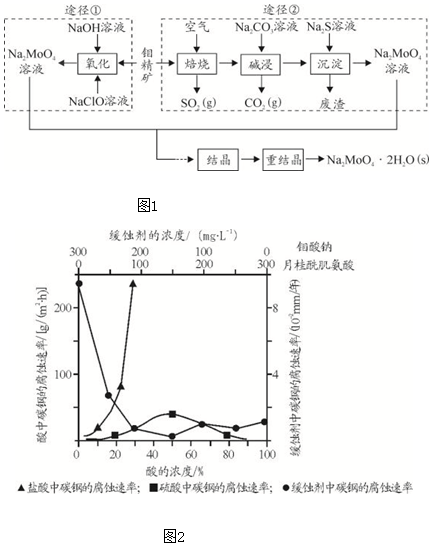

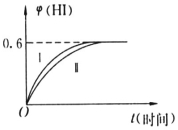 将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).
将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).