题目内容
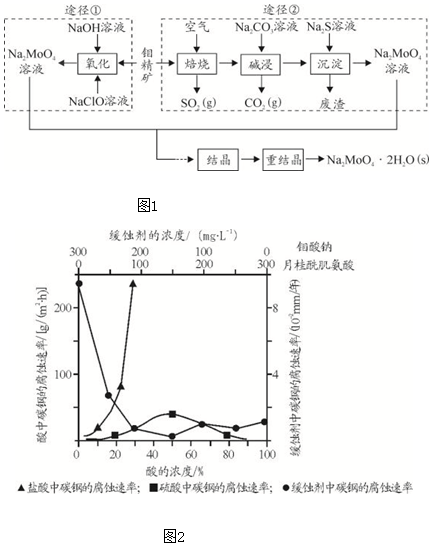
12.氮化铝(AlN)是一种新型无机非金属材料,为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中AlN的含量,某实验小组设计了如下两种实验方案.已知:AlN+NaOH+H2O═NaAlO2+NH3↑【方案1】取一定量的样品,用图1装置测定样品中AlN的纯度(夹持装置已略去).
(1)图1C装置中球形干燥管的作用是防止倒吸.
(2)完成以下实验步骤:组装好实验装置,首先检查装置的气密性,再加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是把装置中残留的氨气全部赶入C装置.
(3)由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见C装置出口处连接一个干燥装置.
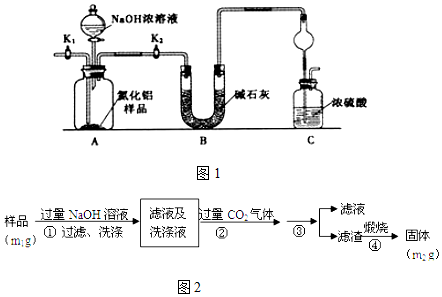
【方案2】按图2步骤测定样品中A1N的纯度:
(4)图2步骤②生成沉淀的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓.
(5)图2步骤③的操作是过滤、洗涤.A1N的纯度是$\frac{41{m}_{2}}{51{m}_{1}}$×100%(用m1、m2表示).
分析 【方案l】测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的质量来计算氮化铝的含量.
(1)分析装置和仪器作用分析,氨气是和浓硫酸能发生反应的气体,易发生倒吸,仪器作用是防止倒吸的作用;
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)若去掉装置B,测定氨气含量会增大,AlN的含量会增大,计算装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
【方案2】流程分析可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(4)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠;
(5)上述分析可知步骤③是过滤洗涤得到氢氧化铝沉淀,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量.
解答 解:【方案1】(1)氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,
故答案为:防止倒吸;
(2)组装好实验装置,气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:关闭K1,打开K2;把装置中残留的氨气全部赶入C装置;
(3)若去掉装置B,测定氨气含量会增大,导致AlN的含量测定结果偏高,装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
故答案为:C装置出口处连接一个干燥装置;
【方案2】流程分析可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(4)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(5)上述分析可知步骤③是过滤洗涤得到氢氧化铝沉淀,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量,Al2O3物质的量=$\frac{{m}_{2}g}{102g/mol}$=$\frac{{m}_{2}}{102}$mol,依据氮元素守恒得到样品中氮元素物质的量=n(AlN)=$\frac{{m}_{2}}{102}$mol×2=$\frac{{m}_{2}}{51}$mol,A1N的纯度=$\frac{\frac{{m}_{2}}{51}mol×41g/mol}{{m}_{1}g}$×100%=$\frac{41{m}_{2}}{51{m}_{1}}$×100%,
故答案为:过滤、洗涤;$\frac{41{m}_{2}}{51{m}_{1}}$×100%.
点评 本题考查了物质性质的探究实验设计和氮化铝含量的测定,实验基本操作和物质性质的掌握是关键,题目难度中等.

| A. | 若增大压强,则物质Y的转化率减小 | |
| B. | 将容器体积变为5 L,Z的平衡浓度变为原来的2倍 | |
| C. | Y浓度变化表示的反应速率为0.0005 mol/(L•s ) | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
①取一定量的无水Na2SO4和碳粉进行隔绝空气高温灼烧;
②将灼烧产物冷却后,加入NaOH溶液进行碱浸
③过滤,滤液经过一系列的操作步骤后得到硫化钠晶体.
(1)过滤需要用到的主要玻璃仪器是漏斗、烧杯、玻璃棒.
(2)若灼烧所得气体为等物质的量的CO和CO2,写出灼烧时发生的化学反应方程为3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑.
(3)上述流程中采用a浸洗更好.
a.稀NaOH溶液b.热水c.氨水d.乙醇
(4)固体产物Na2S晶体中可能含有杂质,该课题组对固体产物的杂质成分提出以下假设:
假设一:杂质成分为NaOH;
假设二:杂质成分为Na2SO4;
假设三:杂质成分为NaOH和Na2SO4.
为验证假设三成立,课题组进行如下研究,请你完成下表中的内容:
| 实验步骤 | 预期的实验现象和结论 |
| 步骤:取一定量的固体产物于试管中,加入适量蒸馏水进行溶解,然后往试管中加入适量的 CuCl2溶液并过滤. | \ |
| 步骤2: 取1的滤液加入酚酞试液,若溶液变红, | 说明有NaOH |
| 步骤3: 取1的滤液加入BaCl2溶液,若产生白色沉淀, | 说明有Na2SO4 |
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为0.045mol/L(精确到千分位).
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为CuO和Fe2O3质量为1.6g.
| A. | 重结晶纯化法 | B. | 萃取纯化法 | C. | 吸附纯化法 | D. | 蒸馏纯化法 |
| A. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| B. | 0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键数目为3NA | |
| D. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA |
 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.