题目内容
14.工业中采用适当的催化剂利用反应CO(g)+2H2(g)═CH3OH(g)来制取甲醇.维持体系的压强一定,温度为T时,在体积为2.0L的封闭容器内充入0.6mol CO和0,.4mol H2,达到平衡时含有0.15mol CH3OH(g),则该反应平衡常数K=65.33(保留两位小数),此时向容器中再通入0.7mol CO气体,则此平衡将逆向(填“正向”、“不”或“逆向”)移动.
分析 利用三段式计算平衡时各物质的物质的量,再计算化学平衡常数;平衡后通入0.7mol CO气体,计算Qc,根据Qc与K的大小关系判断.
解答 解:根据三段式计算,
CO(g)+2H2(g)?CH3OH(g)
起始物质的量(mol) 0.6 0.4 0
转化物质的量(mol) 0.15 0.3 0.15
平衡物质的量(mol) 0.45 0.1 0.15
由于容器内压强不变,气体的物质的量之比等于体积比,则平衡时$\frac{1mol}{0.7mol}=\frac{2L}{VL}$,V=1.4L,
所以K=$\frac{[C{H}_{3}OH]}{[CO]•[{H}_{2}]^{2}}$=$\frac{\frac{0.15mol}{1.4L}}{\frac{0.45mol}{1.4L}×(\frac{0.1mol}{1.4L})^{2}}$=65.33;
平衡后通入0.7mol CO气体,
容器的体积变为2.8L,
则Qc=$\frac{[C{H}_{3}OH]}{[CO]•[{H}_{2}]^{2}}$=$\frac{\frac{0.15mol}{2.8L}}{\frac{1.15mol}{2.8L}×(\frac{0.1}{2.8L})^{2}}$=102.26>K,则平衡逆向移动;
故答案为:65.33;逆向.
点评 本题考查了化学平衡移动的影响因素和化学平衡常数的计算,题目难度中等,注意把握三段式在化学平衡常数计算中的应用方法,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
2.下列叙述中正确的是( )
| A. | 强电解质的水溶液中不存在分子 | |
| B. | 纯水和干木头都不导电,但木头用水浸湿后却可以导电 | |
| C. | 某溶液的PH=7,该溶液一定呈中性 | |
| D. | 不溶性盐都是弱电解质,可溶性酸和强碱都是强电解质 |
9.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有哪些试剂的洗气瓶( )
| A. | 浓H2SO4,酸性KMnO4溶液 | B. | 浓H2SO4,溴水 | ||
| C. | 溴水,浓H2SO4 | D. | 澄清的石灰水,浓H2SO4 |
3.下列氧化还原反应中,电子转移的方向和数目均正确的是( )
| A. |  | B. | 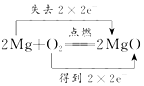 | ||
| C. | 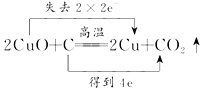 | D. | 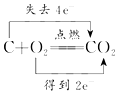 |
4.进行化学实验时必须注意安全,下列说法正确的是( )
| A. | 点燃氢气等易燃性气体前,必须检验气体的纯度 | |
| B. | 用嘴吹灭酒精灯火焰 | |
| C. | 加热试管里的液体时,试管口对着他人 | |
| D. | 把水注入浓硫酸中进行稀释 |
 C和Si元素在化学中占有极其重要的地位:
C和Si元素在化学中占有极其重要的地位: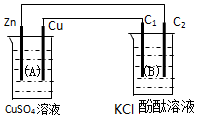 按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.
按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.