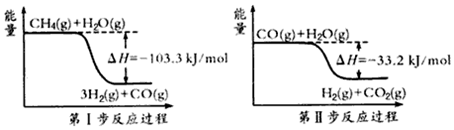
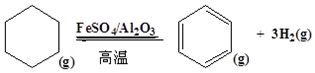题目内容
2.下列叙述中正确的是( )| A. | 强电解质的水溶液中不存在分子 | |
| B. | 纯水和干木头都不导电,但木头用水浸湿后却可以导电 | |
| C. | 某溶液的PH=7,该溶液一定呈中性 | |
| D. | 不溶性盐都是弱电解质,可溶性酸和强碱都是强电解质 |
分析 A.强电解质在溶液中完全电离出离子,溶液中不存在电解质分子,存在水分子;
B.没形成溶液,就没有可自由移动的离子;
C.根据25℃,Kw=c(H+)•c(OH-)=10-14分析;
D.在水中全部电离是强电解质,和溶解度无关;
解答 解:A.强电解质在溶液中完全电离成离子,所以溶液中不存在电解质分子,但存在水分子,故A错误;
B.用水浸湿后,木头上的电解质溶液导电,故B正确;
C.25℃,水的离子积Kw=1×10-14,溶液呈中性,溶液中c(OH-)=c(H+),则PH=7,温度未知,不能确定pH=7的溶液是否为中性,故C错误;
D.如硫酸钡难溶于水,但溶解部分完全电离,所以仍是强电解质.醋酸铅可溶于水,但却是弱电解质,故D错误;
故选B.
点评 本题考查溶液酸碱性的判断、电解质分类、物质导电原因等,为高频考点,把握氢离子浓度、酸碱性判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时,已知数据如表所示:
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的溶液的说法,比较合理的( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中加入少量铁粉即能观察到红色固体析出 | |
| B. | 向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 | |
| C. | 该混合溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4 | |
| D. | 向该混合溶液中加入适量氯水,并调节pH为3~4,然后过滤,可得到纯净的CuSO4溶液 |
17.(1)工业废水中含有重金属离子Cu2+,需要将其转化沉淀除去,请选择合适沉淀剂Na2S、K2S溶液.己知常温下:
Cu(OH)2 KSP=2.2×10-23
CuS KSP=6.3×10-36
(2)①完成表格办1mol/L下列离子,沉淀完全阳离子浓度为10-5 mol/L
②能否控制pH将三种离子逐一分离出溶液通过调PH为3.2~4.7,可以先将铁离子沉淀分离出溶液,如果将PH调至6.7,可以将铜离子完全沉淀分离出去,但同时大部分亚铁离子也沉淀了,即铜离子和亚铁离子无法分离,.
Cu(OH)2 KSP=2.2×10-23
CuS KSP=6.3×10-36
(2)①完成表格办1mol/L下列离子,沉淀完全阳离子浓度为10-5 mol/L
| Fe2+ | Fe3+ | Cu2+ | |
| 开始沉淀时pH | |||
| 完全沉淀时pH | 8 | 3.2 | 6.7 |
7.下列各组混合物可用分液漏斗分离的一组是( )
| A. | 汽油和水 | B. | 碘和四氯化碳 | C. | 淀粉溶液和泥沙 | D. | 水和酒精 |
11.下列措施不能使3Fe(s)+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4(s)+4H2(g)反应速率改变的是( )
①增加铁的用量
②恒压下增加水的用量
③用铁粉代替铁屑
④升温
⑤压强不变,充入N2使容器体积增大.
①增加铁的用量
②恒压下增加水的用量
③用铁粉代替铁屑
④升温
⑤压强不变,充入N2使容器体积增大.
| A. | ① | B. | ②③④ | C. | ①②④ | D. | ①②⑤ |
12.在常温下,体积相同、pH均为3的醋酸和硫酸的说法正确的是( )
| A. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO${\;}_{4}^{2-}$)相等 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |