题目内容
6.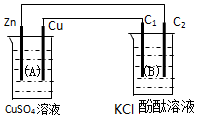 按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.
按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.(1)锌极为负极,电极反应式为:Zn-2e-=Zn2+;
石墨棒C1为阳极,电极反应式为:2Cl--2e-=Cl2↑;
石墨棒C2附近观察到的实验现象为有气泡,溶液变红;
(2)当C2极析出224mL气体(标准状态)时,锌的质量减小0.65g,A池中溶液的质量变化增大(填增大、不变或减小)0.01g.
分析 该装置A中有自发进行的氧化还原反应为原电池,锌易失电子作负极,铜作正极,B为电解池,B中连接铜的电极为阳极,连接锌的电极为阴极,电解池中阳极上氯离子放电,阴极上氢离子放电,根据串联电路中得失电子守恒计算.
解答 解:(1)A中有自发进行的氧化还原反应,能将化学能转化为电能,活泼性较强的Zn为负极,电极反应式为Zn-2e-=Zn2+;活泼性较弱的Cu为正极,石墨棒C1与正极相连为阳极,阳极上氯离子失电子生成氯气,其电极反应式为:2Cl--2e-=Cl2↑;石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,所以阴极附近有气泡,溶液变红,
故答案为:负;Zn-2e-=Zn2+;阳;2Cl--2e-=Cl2↑;有气泡,溶液变红;
(2)石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,其电极方程式为:4H2O+4e-=2H2↑+4OH-,当C2极析出224mL气体(标准状态)时,生成氢气的物质的量为n(H2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,则转移的电子为0.02mol,Zn电极的方程式为:Zn-2e-=Zn2+,根据电子守恒可知,消耗的Zn为0.01mol,则锌的质量减少0.65g;根据A中电池反应式Zn+Cu2+=Cu+Zn2+,故生成铜单质是0.01mol,质量是0.64g,CuSO4溶液的质量增加了0.65g-0.64g=0.01g,
故答案为:0.65;增大;0.01.
点评 本题考查了原电池和电解池原理,正确判断原电池和电解池的电极反应是解本题关键,难点是电极反应式的书写和电子守恒的应用,难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
16.下列说法或表示方法正确的是( )
| A. | 等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量一样多 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 在101kpa时,2gH2完全燃烧,生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol | |
| D. | 在强酸强碱稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含1molNaOH的溶液和含0.5molH2SO4的浓硫酸混合,放出的热量大于57.3 kJ |
17.(1)工业废水中含有重金属离子Cu2+,需要将其转化沉淀除去,请选择合适沉淀剂Na2S、K2S溶液.己知常温下:
Cu(OH)2 KSP=2.2×10-23
CuS KSP=6.3×10-36
(2)①完成表格办1mol/L下列离子,沉淀完全阳离子浓度为10-5 mol/L
②能否控制pH将三种离子逐一分离出溶液通过调PH为3.2~4.7,可以先将铁离子沉淀分离出溶液,如果将PH调至6.7,可以将铜离子完全沉淀分离出去,但同时大部分亚铁离子也沉淀了,即铜离子和亚铁离子无法分离,.
Cu(OH)2 KSP=2.2×10-23
CuS KSP=6.3×10-36
(2)①完成表格办1mol/L下列离子,沉淀完全阳离子浓度为10-5 mol/L
| Fe2+ | Fe3+ | Cu2+ | |
| 开始沉淀时pH | |||
| 完全沉淀时pH | 8 | 3.2 | 6.7 |
1.下列有关化学科学的说法中正确的是( )
| A. | 我们的祖先很早就学会了烧制陶瓷、冶炼金属、酿造酒类 | |
| B. | 化学研究的主要目的是认识分子 | |
| C. | 化学科学无法帮助研究人员了解疾病的病理 | |
| D. | 意大利化学家阿伏伽德罗提出了原子学说,为近代化学的发展奠定了基础 |
11.下列措施不能使3Fe(s)+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4(s)+4H2(g)反应速率改变的是( )
①增加铁的用量
②恒压下增加水的用量
③用铁粉代替铁屑
④升温
⑤压强不变,充入N2使容器体积增大.
①增加铁的用量
②恒压下增加水的用量
③用铁粉代替铁屑
④升温
⑤压强不变,充入N2使容器体积增大.
| A. | ① | B. | ②③④ | C. | ①②④ | D. | ①②⑤ |
18.室温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 由水电离产生的c(H+)=1×10-12 mol•L-1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 室温下,pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | 加酚酞呈红色的溶液中:CO32-、Cl-、F-、NH4+ | |
| D. | c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、Cl-、Fe3+ |
15.下列溶液中Cl-浓度最小的是( )
| A. | 200mL2mol/LMgCl2溶液 | B. | 1000mL2.5mol/LNaCl溶液 | ||
| C. | 300mL5mol/LFeCl3溶液 | D. | 250mL lmol/L AlCl3溶液 |
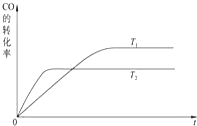 甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.