题目内容
3.下列氧化还原反应中,电子转移的方向和数目均正确的是( )| A. |  | B. | 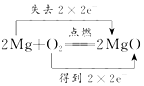 | ||
| C. | 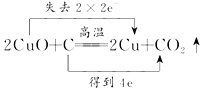 | D. | 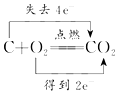 |
分析 A、反应中Cl元素化合价降低得电子,氧元素升高失电子,转移电子数为12;
B、Mg与氧气反应,Mg失电子,氧气得电子,转移电子数为4;
C、CuO与C反应,铜得电子,C失电子;
D、氧化还原反应中得失电子数应该相等.
解答 解:A、2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑中Cl元素化合价降低得电子,氧元素升高失电子,转移电子数为12,则电子转移的方向和数目为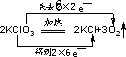 ,故A错误;
,故A错误;
B、Mg与氧气反应,Mg失电子,氧气得电子,转移电子数为4,则电子转移的方向和数目为 ,故B正确;
,故B正确;
C、CuO与C反应,铜得电子,C失电子,则电子转移的方向和数目为 ,故C错误;
,故C错误;
D、氧化还原反应中得失电子数应该相等,则碳与氧气反应时,电子转移的方向和数目为 ,故D错误.
,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意从元素化合价的角度分析,能用双线桥标出电子转移的方向和数目,难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
11.下列措施不能使3Fe(s)+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4(s)+4H2(g)反应速率改变的是( )
①增加铁的用量
②恒压下增加水的用量
③用铁粉代替铁屑
④升温
⑤压强不变,充入N2使容器体积增大.
①增加铁的用量
②恒压下增加水的用量
③用铁粉代替铁屑
④升温
⑤压强不变,充入N2使容器体积增大.
| A. | ① | B. | ②③④ | C. | ①②④ | D. | ①②⑤ |
18.室温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 由水电离产生的c(H+)=1×10-12 mol•L-1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 室温下,pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | 加酚酞呈红色的溶液中:CO32-、Cl-、F-、NH4+ | |
| D. | c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、Cl-、Fe3+ |
8.氧气的摩尔质量是( )
| A. | 32g | B. | 16g | C. | 32g/mol | D. | 16g/mol |
15.下列溶液中Cl-浓度最小的是( )
| A. | 200mL2mol/LMgCl2溶液 | B. | 1000mL2.5mol/LNaCl溶液 | ||
| C. | 300mL5mol/LFeCl3溶液 | D. | 250mL lmol/L AlCl3溶液 |
12.在常温下,体积相同、pH均为3的醋酸和硫酸的说法正确的是( )
| A. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO${\;}_{4}^{2-}$)相等 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |