题目内容
4.进行化学实验时必须注意安全,下列说法正确的是( )| A. | 点燃氢气等易燃性气体前,必须检验气体的纯度 | |
| B. | 用嘴吹灭酒精灯火焰 | |
| C. | 加热试管里的液体时,试管口对着他人 | |
| D. | 把水注入浓硫酸中进行稀释 |
分析 A.不纯的氢气等易燃气体,点燃容易发生爆炸;
B.根据熄灭酒精灯要用灯帽盖灭进行解答;
C.加热试管里的液体时,试管口不能对着自己或者他人;
D.浓硫酸稀释产生大量的热;
解答 解:A.不纯的氢气等易燃气体,点燃容易发生爆炸,所以点燃前应检查纯度,故A正确;
B.熄灭酒精灯要用灯帽盖灭,不可用嘴吹灭,故B错误;
C.加热试管里的液体时,试管口对着他人容易造成伤害,试管口不能对着自己或者他人,故C错误;
D.浓硫酸稀释产生大量的热,稀释浓硫酸应将浓硫酸注入水中,并不断搅拌,故D错误;
故选:A.
点评 化学是以实验为基础的学科,掌握正确的化学实验操作是同学们必须具备的能力,注意对常见化学事故的处理方法的积累,题目难度不大.

练习册系列答案
相关题目
15.下列溶液中Cl-浓度最小的是( )
| A. | 200mL2mol/LMgCl2溶液 | B. | 1000mL2.5mol/LNaCl溶液 | ||
| C. | 300mL5mol/LFeCl3溶液 | D. | 250mL lmol/L AlCl3溶液 |
12.在常温下,体积相同、pH均为3的醋酸和硫酸的说法正确的是( )
| A. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO${\;}_{4}^{2-}$)相等 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |
19.下列做法对人体健康不会造成危害的是( )
| A. | 用工业盐(NaNO2)作咸味调味品 | |
| B. | 用硫磺熏制银耳,使它颜色更白 | |
| C. | 食盐中加入一定量的碘酸钾(KIO3)制取加碘食盐 | |
| D. | 将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒 |
9.下列事实可用勒夏特列原理解释的是( )
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 500℃左右比在室温时更有利于提高合成氨的转化率 | |
| C. | 硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 | |
| D. | 对2HI?H2+I2平衡体系增加压强使颜色变深 |
3.亚硝酸氯(ClNO)是有机合成中的重要试剂.亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)2ClNO(g).
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)?2ClNO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$.
(2)T℃时,2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k cn(ClNO),测得速率和浓度的关系如表:
n=2;k=4.0×10-7mol-1•L•s-1(注明单位).
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
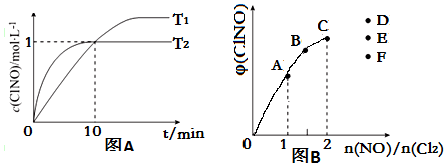
①温度为T1时,能作为该反应达到平衡的标志的有bdf;
a.容器体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.v(ClNO)=v(NO) f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=0.05mol•L-1•min-1;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=2L/mol(注明单位).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随$\frac{n(NO)}{n(C{l}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是C点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的F点.
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)?2ClNO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$.
(2)T℃时,2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k cn(ClNO),测得速率和浓度的关系如表:
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-7 |
| ③ | 0.90 | 3.24×10-7 |
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:

①温度为T1时,能作为该反应达到平衡的标志的有bdf;
a.容器体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.v(ClNO)=v(NO) f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=0.05mol•L-1•min-1;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=2L/mol(注明单位).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随$\frac{n(NO)}{n(C{l}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是C点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的F点.
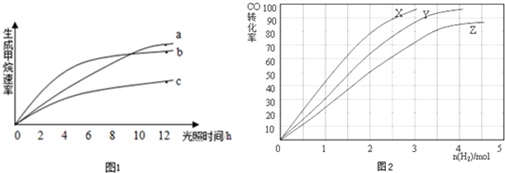
 甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ/mol. 在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.