题目内容
14.下列反应的离子方程式不正确的是( )| A. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸、双氧水:2H++2I-+H2O2═I2+2H2O | |
| D. | 用H2S沉淀硫酸铜中铜离子:S2-+Cu2+═CuS↓ |
分析 A.存在水解平衡;
B.发生氧化还原反应,遵循电子、电荷守恒;
C.发生氧化还原反应生成碘和水;
D.硫化氢在离子反应中保留化学式.
解答 解:A.K2Cr2O7的溶液中存在的平衡体系的离子反应为Cr2O72-+H2O?2CrO42-+2H+,故A正确;
B.硫代硫酸钠与硫酸发生的氧化还原反应的离子方程式为S2O32-+2H+═SO2↑+S↓+H2O,故B正确;
C.KI溶液中滴加稀硫酸、双氧水的离子反应为2H++2I-+H2O2═I2+2H2O,故C正确;
D.用H2S沉淀硫酸铜中铜离子的离子反应为H2S+Cu2+═CuS↓+2H+,故D错误;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
5.七种短周期元素在元素周期表中的相对位置如表所示.其中B的最高价氧化物的水化物能与B的气态氢化物反应生成离子化合物,下列说法不正确的是( )
| A | B | C | ||
| D | E | F | G |
| A. | G的最高价氧化物对应的水化物是最强的酸 | |
| B. | 熔融电解化合物D2C3可制取单质D | |
| C. | F的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
2.下列变化中证明硫酸是强酸的是( )
| A. | 和铜反应 | B. | 和锌反应放出H2 | ||
| C. | 与NaCl反应制HCl | D. | 与Ca3(PO4)2反应制H3PO4 |
6.在常温下,下列溶液不能溶解铁的是( )
| A. | 稀硫酸 | B. | FeCl3溶液 | C. | CuCl2 | D. | 浓硝酸 |
4.下列变化中不属于化学变化的是( )
| A. | 紫色的石蕊试液中通入CO2后变色 | B. | SO2漂白草编制品 | ||
| C. | 木炭使红棕色的NO2气体褪色 | D. | 淀粉遇碘变蓝色 |
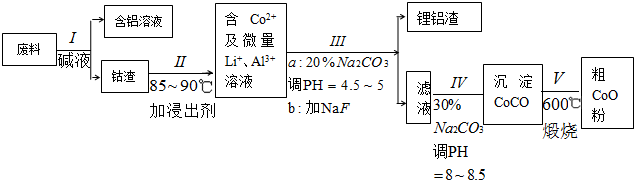
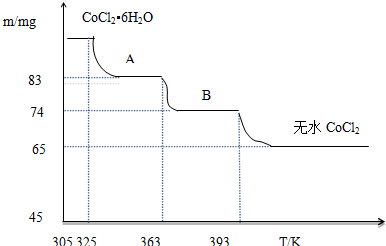
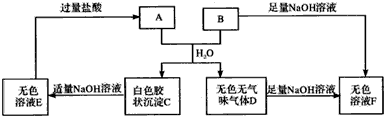
 ;
; ;C的化学名称为2,3-二甲基-1,3-丁二烯.
;C的化学名称为2,3-二甲基-1,3-丁二烯.