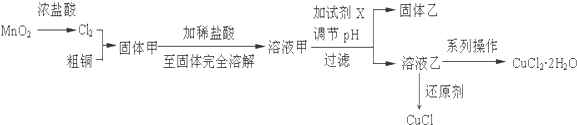
题目内容
3.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子.(1)A的结构简式为
 ;
;(2)已知A、B、C有下列转化关系,则反应②的化学方程式为
 ;C的化学名称为2,3-二甲基-1,3-丁二烯.
;C的化学名称为2,3-二甲基-1,3-丁二烯.A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH、C_{2}H_{5}OH,△}$C(C6H10)
分析 A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,则A应为烯烃,设分子式为CnH2n,则有14n=84,n=6,核磁共振谱表明分子中只有一种类型的氢,说明结构对称,其结构简式应为 ,则B为
,则B为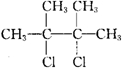 ,在乙醇的碱性溶液中加热时发生消去反应,生成的C为
,在乙醇的碱性溶液中加热时发生消去反应,生成的C为 ,据此解答.
,据此解答.
解答 解:A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,则A应为烯烃,设分子式为CnH2n,则有14n=84,n=6,核磁共振谱表明分子中只有一种类型的氢,说明结构对称,其结构简式应为 ,则B为
,则B为 ,在乙醇的碱性溶液中加热时发生消去反应,生成的C为
,在乙醇的碱性溶液中加热时发生消去反应,生成的C为 ,
,
(1)由上述分析可知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)反应②的化学方程式为 ;C为
;C为 ,化学名称为:2,3-二甲基-1,3-丁二烯.
,化学名称为:2,3-二甲基-1,3-丁二烯.
故答案为: ;2,3-二甲基-1,3-丁二烯.
;2,3-二甲基-1,3-丁二烯.
点评 本题考查有机物推断与合成,为高频考点,侧重于学生的分析能力的考查,题目难度中等,确定A的结构是解题的关键,注意官能团的性质进行推断.

练习册系列答案
相关题目
13.下列关于甲、乙、丙、丁四组仪器装置的有关用法正确且能达到目的是( )


| A. | 甲装置:可用来证明硫的非金属性比硅强 | |
| B. | 乙装置:用盐酸标准液测氢氧化钠溶液浓度 | |
| C. | 丙装置:配制一定物质的量浓度的氢氧化钠溶液 | |
| D. | 丁装置:可在瓶中先装满水,气体由②口入,收集NO气体 |
14.下列反应的离子方程式不正确的是( )
| A. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸、双氧水:2H++2I-+H2O2═I2+2H2O | |
| D. | 用H2S沉淀硫酸铜中铜离子:S2-+Cu2+═CuS↓ |
11.下列实验装置不能达到目的是( )
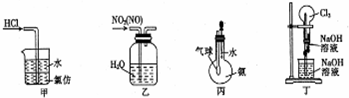

| A. | 装置甲:用于吸收HCl气体 | B. | 装置乙:用于除去NO2中的NO | ||
| C. | 装置丙:可验证氨气极易溶于水 | D. | 装置丁:可形成喷泉 |
12.下列反应的离子方程式正确的是( )
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 向NaClO溶液中滴加少量FeSO4溶液:5ClO-+2Fe2++5H2O═4HClO+Cl-+2Fe(OH)3↓ | |
| C. | 向NH4HCO3稀溶液中滴加过量Ca(OH)2溶液:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| D. | 向CuSO4溶液中滴加过量氨水:Cu2++2 NH3•H2O═Cu(OH)2↓+2 NH4+ |
13.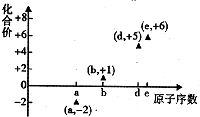 如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
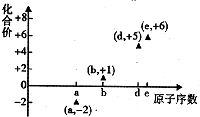 如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
如图是邵分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d属于同种核素 | B. | 第一电离能d>e,电负性d<e | ||
| C. | 气态氢化物的稳定性:a>d>e | D. | a和b形成的化合物不可能含共价键 |

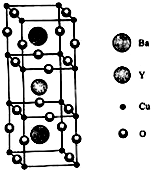 铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.
铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.