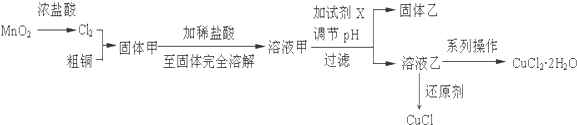
题目内容
9.弱电解质的电离平衡、盐的水解平衡都可看作化学平衡的一种.请根据所学化学知识回答下列问题: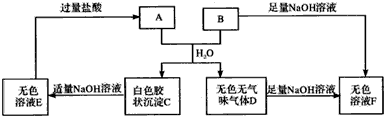
(1)次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,则NaH2PO2是正盐(填“正盐”还是“酸式盐”),其溶液中离子浓度由大到小的顺序应为c(Na+)>c(H2PO2-)>c(OH-)>c(H+ ),将0.2mol•L-1 H3PO2溶液与0.2mol•L-1NaOH溶液等体积混合后所得溶液中:c(H2PO2-)+c(OH-)-c(H+)=0.1mol•L-1.(溶液体积变化忽略不计)
(2)某同学查阅资料得知常温下0.1mol•L-1Na2CO3中,发生水解的CO32-不超过其总量的10%.请设计实验加以证明测0.1 mol•L-1Na2CO3溶液pH,pH≤12(写出实验方案及预期观察到的现象).
(3)室温下,向0.01mol•L-1NH4HSO4溶液中滴加0.01mol•L-1NaOH溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(4)由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A和B的混合物溶于水发生反应的离子方程式Al3++3HCO3-=Al(OH)3↓+3CO2↑.
B、E两溶液混合反应时,其反应的离子方程式AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-.
分析 (1)次磷酸(H3PO2)是一元中强酸,则NaH2PO2是正盐;溶液中H2PO2-水解,溶液呈碱性;根据电荷守恒有:c(Na+)+c(H+ )=c(H2PO2-)+c(OH-);
(2)10%的Na2CO3发生水解,溶液中氢氧根离子浓度约是为0.01mol/L,可以测定溶液pH证明;
(3)溶液呈中性,说明加入的NaOH的物质的量大于NH4HSO4的物质的量,因为硫酸铵为酸性;
(4)B的焰色反应呈黄色,应含有钠元素,由题给转化关系可知,C为Al(OH)3,D为CO2,则B为NaHCO3,F为Na2CO3,E为NaAlO2,A为AlCl3.
解答 解:(1)次磷酸(H3PO2)是一元中强酸,则NaH2PO2是正盐,溶液中H2PO2-水解,溶液呈碱性,溶液中离子浓度由大到小顺序为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+ ),根据电荷守恒有:c(Na+)+c(H+ )=c(H2PO2-)+c(OH-),混合后溶液中c(Na+)=0.1mol/L,则c(H2PO2-)+c(OH-)-c(H+)=c(Na+)=0.1mol/L.
故答案为:正盐;c(Na+)>c(H2PO2-)>c(OH-)>c(H+ );0.1;
(2)10%的Na2CO3发生水解,溶液中氢氧根离子浓度约是为0.01mol/L,测0.1 mol•L-1Na2CO3溶液pH,pH≤12,说明发生水解的CO32-不超过其总量的10%,
故答案为:测0.1 mol•L-1Na2CO3溶液pH,pH≤12;
(3)溶液呈中性,说明加入的NaOH的物质的量大于NH4HSO4的物质的量,因为硫酸铵为酸性,溶液中铵根离子水解,故溶液中离子浓度:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
(4)B的焰色反应呈黄色,应含有钠元素,由题给转化关系可知,C为Al(OH)3,D为CO2,则B为NaHCO3,F为Na2CO3,E为NaAlO2,A为AlCl3.A和B的混合物溶于水发生反应的离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑,B、E两溶液混合反应时,其反应的离子方程式:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-.
点评 本题考查无机物推断、盐类水解等,实验拼合型题目,离子浓度大小比较中考虑:电解质的电离、盐类水解、电荷守恒、微粒守恒与质子恒等式.

| A. | 豆浆 | B. | 鸡蛋清溶液 | C. | 食盐水 | D. | 淀粉溶液 |
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | FeO与足量的稀硝酸反应: FeO+2H+═Fe2++H2O | 正确 |
| B | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-═BaSO4↓ | 正确 |
| C | 碳酸氢钠溶液中滴加少量的石灰水: 2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O | 错误,HCO3-、OH-和H2O的系数应均为1,生成物中没有CO32- |
| D | 用食醋除去水瓶中的水垢: CaCO3+2H+═Ca2++H2O+CO2↑ | 错误,醋酸是弱酸,不应写成H+形式 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 加入较多NaHSO4的溶液中:Fe3+、Cl-、NO3-、Na+ | |
| B. | 通入大量CO2气体的溶液中:Na+、Ba2+、Cl-、NO3- | |
| C. | 通入大量NH3的溶液中:Ca2+、Na+、HCO3-、Cl- | |
| D. | 通入大量SO2气体的溶液中:Na+、SO32-、NH4+、SO42- |
| A. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸、双氧水:2H++2I-+H2O2═I2+2H2O | |
| D. | 用H2S沉淀硫酸铜中铜离子:S2-+Cu2+═CuS↓ |
提出问题:Fe3+、Br2谁的氧化性更强?
(1)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(2)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是:Fe2+(填离子的化学式).
②在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol•L-1.