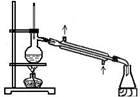
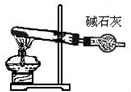
题目内容
2.下列变化中证明硫酸是强酸的是( )| A. | 和铜反应 | B. | 和锌反应放出H2 | ||
| C. | 与NaCl反应制HCl | D. | 与Ca3(PO4)2反应制H3PO4 |
分析 证明硫酸是强酸可以证明硫酸为强电解质,或者依据强酸制备弱酸规律,据此解答.
解答 解:A.浓硫酸与铜反应,体现强的氧化性,不能证明硫酸是强酸,故A错误;
B.能跟锌反应产生氢气,只能说明硫酸呈酸性,无法判断硫酸是强酸,故B错误;
C.浓硫酸与氯化钠反应制取氯化氢,利用的是硫酸不挥发、氯化氢挥发的性质,无法判断硫酸为酸性,故C错误;
D.磷酸为中强酸,硫酸能够与Ca3(PO4)2反应制H3PO4,说明酸性强于磷酸,为强酸,故D正确;
故选:D.
点评 本题考查硫酸的性质,侧重于电解质的强弱的判断,难度不大.注意把握实验设计的角度和可行性的评价.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
12.下列各组溶液,不另加其他试剂就可以将它们分别开的是( )
| A. | NaCl、HCl、NaAlO2、NaHCO3 | B. | NaSO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、AlCl3、HNO3 | D. | AgNO3、NaCl、NaSO4、NaI |
13.下列关于甲、乙、丙、丁四组仪器装置的有关用法正确且能达到目的是( )


| A. | 甲装置:可用来证明硫的非金属性比硅强 | |
| B. | 乙装置:用盐酸标准液测氢氧化钠溶液浓度 | |
| C. | 丙装置:配制一定物质的量浓度的氢氧化钠溶液 | |
| D. | 丁装置:可在瓶中先装满水,气体由②口入,收集NO气体 |
17.如表中评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | FeO与足量的稀硝酸反应: FeO+2H+═Fe2++H2O | 正确 |
| B | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-═BaSO4↓ | 正确 |
| C | 碳酸氢钠溶液中滴加少量的石灰水: 2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O | 错误,HCO3-、OH-和H2O的系数应均为1,生成物中没有CO32- |
| D | 用食醋除去水瓶中的水垢: CaCO3+2H+═Ca2++H2O+CO2↑ | 错误,醋酸是弱酸,不应写成H+形式 |
| A. | A | B. | B | C. | C | D. | D |
7.可逆反应A(g)+3B(g)?2C(g);△H=-Q kJ/mol.有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=4Q2.下列叙述不正确的是( )
| A. | 乙中C的转化率为20% | |
| B. | Q1+Q2=Q | |
| C. | 达到平衡后,再向乙中加入0.25 molA、0.75molB、1.5molC,平衡向正反应方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g);△H=+Q2kJ•mol-1 |
14.下列反应的离子方程式不正确的是( )
| A. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸、双氧水:2H++2I-+H2O2═I2+2H2O | |
| D. | 用H2S沉淀硫酸铜中铜离子:S2-+Cu2+═CuS↓ |
11.下列实验装置不能达到目的是( )
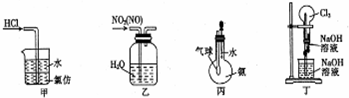

| A. | 装置甲:用于吸收HCl气体 | B. | 装置乙:用于除去NO2中的NO | ||
| C. | 装置丙:可验证氨气极易溶于水 | D. | 装置丁:可形成喷泉 |
12.下列反应的离子方程式正确的是( )
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 向NaClO溶液中滴加少量FeSO4溶液:5ClO-+2Fe2++5H2O═4HClO+Cl-+2Fe(OH)3↓ | |
| C. | 向NH4HCO3稀溶液中滴加过量Ca(OH)2溶液:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| D. | 向CuSO4溶液中滴加过量氨水:Cu2++2 NH3•H2O═Cu(OH)2↓+2 NH4+ |