题目内容
2.2008年北京奥运会“祥云”奥运火炬所用环保型燃料丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5kJ•mol-1;正丁烷的燃烧热为:2878kJ•mol-1;异丁烷的燃烧热为:2869kJ•mol-1.下列有关说法正确的是( )| A. | 丙烷燃烧的热化学方程式可表示为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5 kJ•mol-1 | |
| B. | 正丁烷燃烧的热化学方程式可表示为:2C4H10(g)+18O2(g)=8CO2(g)+10H2O(l);△H=-2878 kJ•mol-1 | |
| C. | 正丁烷转化为异丁烷的过程是一个放热过程 | |
| D. | 正丁烷比异丁烷稳定 |
分析 A.丙烷的燃烧热为:2221.5kJ•mol-1,表示1mol丙烷完全燃烧生成二氧化碳与液态水放出热量为2221.5kJ;
B.正丁烷的燃烧热为:2878kJ•mol-1,表示1mol丁烷完全燃烧生成二氧化碳与液态水放出热量为2878kJ;
C.正丁烷的燃烧热为:2878kJ•mol-1;异丁烷的燃烧热为:2869kJ•mol-1,说明正丁烷的能量更高;
D.能量越高越不稳定.
解答 解:A.丙烷的燃烧热为:2221.5kJ•mol-1,表示1mol丙烷完全燃烧生成二氧化碳与液态水放出热量为2221.5kJ,丙烷燃烧的热化学方程式可表示为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H=-2221.5 kJ•mol-1,故A错误;
B.正丁烷的燃烧热为:2878kJ•mol-1,表示1mol丁烷完全燃烧生成二氧化碳与液态水放出热量为2878kJ,正丁烷燃烧的热化学方程式可表示为:2C4H10(g)+18O2(g)=8CO2(g)+10H2O(l);△H=-5756 kJ•mol-1,故B错误;
C.正丁烷的燃烧热为:2878kJ•mol-1;异丁烷的燃烧热为:2869kJ•mol-1,说明正丁烷的能量更高,正丁烷转化为异丁烷的过程是一个放热过程,故C正确;
D.正丁烷能量比异丁烷的高,则正丁烷不如异丁烷稳定,故D错误.
故选:C.
点评 本题考查燃烧热概念、热化学方程式书写等,注意掌握热化学方程式书写原则,理解燃烧热、中和热等概念.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
12.下列叙述正确的是( )
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 化学反应中的能量变化与反应物的总能量和生成物的总能量的相对大小无关 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
13.工业生产苯乙烯是利用乙苯的脱氢反应:
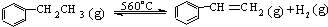 △H>0
△H>0
针对上述反应,有人提出如下观点.其中合理的是( )
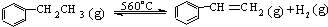 △H>0
△H>0针对上述反应,有人提出如下观点.其中合理的是( )
| A. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率 | |
| B. | 在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量在不断增大 | |
| D. | 不断分离出苯乙烯可加快反应速率 |
17.设阿伏加德罗常数的值为NA,下列叙述正确的是( )
| A. | 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA | |
| B. | 0.1mol${\;}_{35}^{81}$Br原子中含中子数为3.5NA | |
| C. | 6.0g SiO2晶体中含有的硅氧键数目为0.4NA | |
| D. | 7.8g过氧化钠中所含有的阴离子数为0.2NA |
14.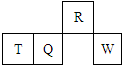 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | W对应的单质只可以跟强碱反应 |