题目内容
10.二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料.工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al2O3):2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-204.7KJ/mol
(1)若反应在恒温、恒压下进行,以下叙述能说明该反应达到平衡状态的是CDE(填序号)
A.CO和H2的物质的量浓度比是1:2
B.CO的消耗速率等于CH3OCH3的生成速率的2倍
C.容器中混合气体的体积保持不变
D.容器中混合气体的平均摩尔质量保持不变
E.容器中混合气体的密度保持不变
(2)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g)△H1=-100.46KJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g)△H2
CO(g)+H2O(g)=CO2(g)+H2(g)△H3=-38.7KJ/mol
则△H2=-3.78kJ/mol
(3)复合催化剂的制备方法之一是Na2CO3共沉淀法:制备1mol/L的硝酸铜,硝酸锌和硝酸铝的水溶液.然后向盛有去离子水的烧杯中同时滴加混合硝酸盐溶液和1mol/L的Na2CO3水溶液,70℃下搅拌混合.沉淀后过滤,洗涤沉淀物,80℃下干燥12小时,然后500℃下焙烧16小时.
请写出上述过程中硝酸铝与Na2CO3水溶液反应的离子方程式:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑.
(4)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的正极(填正、负)极,通DME的电极反应为CH3OCH3+3H2O-12e-=2CO2↑+12H+.
分析 (1)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(2)已知:①CO(g)+2H2(g)=CH3OH(g)△H1=-100.46kJ/mol
②2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol
根据盖斯定律:②-①×2得:2CH3OH(g)=CH3OCH3(g)+H2O(g);
(3)硝酸铝与Na2CO3水溶液发生相互促进的水解反应生成氢氧化铝沉淀和二氧化碳气体;
(4)该燃料电池中,氧气在正极得电子,负极上二甲醚失电子发生氧化反应生成二氧化碳
解答 解:(1)A.CO和H2的物质的量浓度比与反应物的初始量及转化率有关,所以不能说明到达平衡状态,故A错误;
B.CO的消耗速率与CH3OCH3的生成速率都属于正速率,速率之比等于计量数之比,始终为高比例关系,不能说明到达平衡状态,故B错误;
C.随反应进行混合气体总物质的量减少,由于压强不变,则气体的体积会减小,容器中混合气体的体积保持不变,说明到达平衡状态,故C正确;
D.气体的总质量保持不变,气体总物质的量减少,则气体的平均摩尔质量逐渐增大,当容器中混合气体的平均摩尔质量保持不变,说明到达平衡状态,故D正确;
E.气体的总质量保持不变,气体的体积减小,则密度增大,当容器中混合气体的密度保持不变,说明反应到达平衡状态,故E正确;
故答案为:CDE;
(2)已知:①CO(g)+2H2(g)=CH3OH(g)△H1=-100.46kJ/mol
②2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol
根据盖斯定律:②-①×2得:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H2=-204.7kJ/mol-(-100.46kJ/mol)×2=-3.78kJ/mol;
故答案为:-3.78kJ/mol;
(3)硝酸铝与Na2CO3水溶液发生相互促进的水解反应生成氢氧化铝沉淀和二氧化碳气体,其水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑.
(4)该燃料电池中,氧气在正极得电子,则通入氧气的电极是电源的正极,负极上二甲醚失电子发生氧化反应生成二氧化碳,则负极反应式为:CH3OCH3+3H2O-12e-=2CO2↑+12H+,
故答案为:正;CH3OCH3+3H2O-12e-=2CO2↑+12H+.
点评 本题考查了化学平衡状态的判断、盖斯定律的应用、水解反应、电化学原理等,属于拼合型题目,侧重于考查学生对基础知识的综合应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 附着在试管内壁上的AgCl固体可用氨水溶解而洗去 | |
| B. | 可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液 | |
| C. | 向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液 | |
| D. | 加热碘单质,产生紫色蒸气,这个过程克服了范德华力 |
| A. | 电解CuSO4溶液一段时间后,加入适量Cu(OH)2可以使溶液恢复至原状态 | |
| B. | 将钢闸门与直流电源的负极相连,可以防止钢闸门腐蚀 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Cu、Fe、Al | |
| D. | 铅蓄电池在充电时,连接电源正极的电极上发生:PbSO4+2e-═Pb+SO42- |
(1)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图1所示),大大地提高了资源利用率,减少了环境污染.
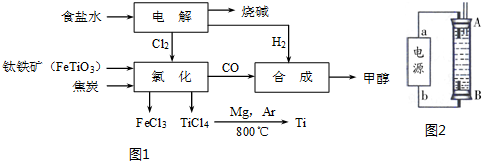
①由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).
已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将向逆反应方向进行(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②写出钛铁矿经氯化得到四氯化钛的化学方程式:2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO.
③若不考虑生产过程中物质的任何损失,该产业链中每合成38.4t甲醇,至少需额外补充H22.0t.
(2)将两个石墨电极插入H2SO4溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8-20e-+6H2O=3CO2+20H+;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图2所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-═H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
| A. | 实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液 | |
| B. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| C. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 | |
| D. | 在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了 |
| A. | H+ | B. | K+ | C. | Cl- | D. | Ba2+ |
| A. | 丙烷燃烧的热化学方程式可表示为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5 kJ•mol-1 | |
| B. | 正丁烷燃烧的热化学方程式可表示为:2C4H10(g)+18O2(g)=8CO2(g)+10H2O(l);△H=-2878 kJ•mol-1 | |
| C. | 正丁烷转化为异丁烷的过程是一个放热过程 | |
| D. | 正丁烷比异丁烷稳定 |