题目内容
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 16g${\;}_{\;}^{18}$O3中含有的中子数为10NA | |
| B. | 密闭条件下,2molSO2和1molO2在密闭容器中充分反应后容器中的分子数大于2NA | |
| C. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| D. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑,若有5molH2O参加反应,则被谁还原BrF3的分子数目为3NA |
分析 A.质量转化为物质的量,结合1个${\;}_{\;}^{18}$O含有10个中子解答;
B.二氧化硫与氧气反应生成三氧化硫为可逆反应,可逆反应不能进行到底;
C.氢氧化钠溶液中,氢氧根离子抑制了水的电离,则水电离的氢氧根离子浓度=氢离子浓度;
D.在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用;
解答 解:A.16g${\;}_{\;}^{18}$O3含有氧原子的质的量为$\frac{16g}{18g/mol}$=0.89mol,含有中子数为8.9NA,故A错误;
B.二氧化硫与氧气反应生成三氧化硫为可逆反应,可逆反应不能进行到底,则2molSO2和1molO2在密闭容器中充分反应后容器中的分子物质的量大于2mol,分子数大于2NA,故B正确;
C.氢氧化钠溶液中,氢氧根离子抑制了水的电离,溶液中的氢离子是水电离的,则水电离的氢氧根离子浓度=氢离子浓度=1×10-13mol/L,故C错误;
D.在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用,所以5molH2O参加反应,则被水还原BrF3的分子数目小于3NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确3BrF3+5H2O═HBrO3+Br2+9HF+O2↑反应中BrF3既起氧化剂也起还原剂是解题关键,题目难度中等.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案| A. | 白银 | B. | 白磷 | C. | 乙烯 | D. | 水银 |

Ⅰ.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为50mg/kg,要达到上述碘含量要求,需服用该碘盐2kg,你觉得服用碘盐防辐射合理吗?不合理
Ⅱ.如图1为某加碘盐标签的一部分.
已知:
①KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
②I2+2Na2S2O3═2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄
色,再加入3滴淀粉溶液.
步骤2:取一支50.00mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算此加碘盐碘元素的含量为$\frac{508000b}{a}$mg/kg(用包含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏高的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失.
| A. | 若a+b<c+d,则反应一定能自发向右进行 | |
| B. | 若起始时A、B的物质的量之比为a:b,则平衡时的转化率之比为1:1 | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n molB,则平衡时气体的总物质的量小于(m+n)mol | |
| D. | 若a+b=c,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大 |
| A. | 100mL 12mol•L-1盐酸溶液与足量MnO2共热,反应生成的气体分子数为0.3NA | |
| B. | 密闭反应容器中充入2mol SO2和1mol O2,充分反应转移电子数为4NA | |
| C. | 25.0g胆矾晶体溶于水配成1L溶液,所得溶液中阳离子数为0.1NA | |
| D. | 常温常压下,0.1mol C5H12所含有的共价键数目为1.6NA |
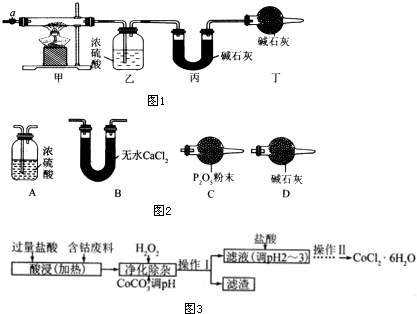
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(或装置甲前)(填装置连接位置).
(4)若按正确装置进行实验,测得如下数据.
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(5)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如图3:
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.请回答:
(1)以上操作步骤中有一步有错误,请指出编号①,该错误操作会导致测定结果偏大(填“偏大”、“偏小”或“无影响”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙中.(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:BC(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断到达滴定终点的现象是:锥形瓶中溶液从无 色变为浅红色,且半分钟之内不再改变.
(5)以下是实验数据记录表:
| 滴定次数 | 盐酸体积(ml) | NaOH溶液体积读数(ml) | |
| 滴定前 | 滴定后 | ||
| 20.00 | 0.00 | 16.30 | |
| 2 | 20.00 | 0.00 | 16.22 |
 .
.