题目内容
8.对于反应:aA(g)+bB(g)?cC(g)+dD(s)△H<0,下列判断不正确的是( )| A. | 若a+b<c+d,则反应一定能自发向右进行 | |
| B. | 若起始时A、B的物质的量之比为a:b,则平衡时的转化率之比为1:1 | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n molB,则平衡时气体的总物质的量小于(m+n)mol | |
| D. | 若a+b=c,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大 |
分析 A.当△G=△H-T•△S<0时,反应能自发进行;
B.反应过程中A、B消耗的物质的量之比为a:b,则平衡时A、B的转化率相等;
C.D为固体,再向其中充入nmolB,平衡向正反应方向移动,气体的总物质的量减小;
D.反应放热,升高温度平衡向逆反应方向移动,根据PV=nRT判断压强的变化.
解答 解:A.D为固体,若(a+b)<(c+d),则△S不一定大于0,当△G=△H-T•△S<0时,反应才能自发进行,故A错误;
B.若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比为1:1,故B正确;
C.D为固体,再向其中充入nmolB,平衡向正反应方向移动,气体的总物质的量减小,则达到平衡时气体总物质的量小于(m+n)mol,故C正确;
D.反应放热,升高温度平衡向逆反应方向移动,a+b=c,则反应前后气体的物质的量不变,在同体积下,温度越高压强越大,则升高温度容器中气体的压强增大,故D正确;
故选A.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学平衡移动的影响因素及反应自发进行的判断,注意掌握化学平衡及其影响因素,易错点为A,注意反应能否自发进行的判断方法,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
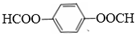
6.经过长时间的努力已经可以解决部分的污染问题,例如可降解塑料的问世,聚二氧化碳塑料就是其中的佼佼者,有关聚二氧化碳塑料的说法正确的是( )
| A. | 聚二氧化碳塑料是通过缩聚反应生成的 | |
| B. | 聚二氧化碳塑料的结构式可表示为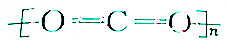 | |
| C. | 聚二氧化碳塑料属于纯净物,相对分子质量为44n | |
| D. | 聚二氧化碳塑料是属于环境友好材料 |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 16g${\;}_{\;}^{18}$O3中含有的中子数为10NA | |
| B. | 密闭条件下,2molSO2和1molO2在密闭容器中充分反应后容器中的分子数大于2NA | |
| C. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| D. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑,若有5molH2O参加反应,则被谁还原BrF3的分子数目为3NA |
20.如图为通过手持技术实时测量冰醋酸稀释过程中电导率和温度的变化曲线,下列关于弱电解质溶液电离过程的说法错误的是( )
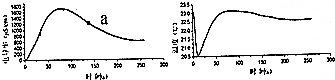

| A. | 冰醋酸稀释过程中,溶液的导电能力先增大后减小 | |
| B. | 左图的曲线也可以表示溶液的pH变化趋势 | |
| C. | 稀释一开始,溶液的温度就下降,可推知电离过程可能是吸热过程 | |
| D. | 可通过微热的方法,使图中a点溶液中的c(CH3COO-)增大 |
17.用NA表示阿伏德罗常数的数值,下列说法正确的是( )
| A. | 常温下,1mol•L-1的Na2CO3溶液中CO32-的数目小于NA | |
| B. | 常温常压下,1.7g NH3中所含的原子数为0.4NA | |
| C. | 向含0.1mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目为0.4NA | |
| D. | 标准状况下,4.48LNO2与足量的水反应,转移的电子数为0.1NA |
18.下列指定条件下,离子方程式书写正确的是( )
| A. | 铜片投入FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | AgCl悬浮液中加入Na2S溶液沉淀变黑:2AgCl+S2-═Ag2S+2Cl- | |
| C. | 用两根铁电极电解CuSO4溶液:2Cu 2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ | |
| D. | Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
 .
. .
. 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.