题目内容
11.在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).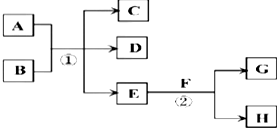
回答下列问题:
(1)写出H的电子式:
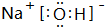 .
.(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,①实验需要检验出C、D、E三种气体产物,三种气体中最先检验的是H2O(用化学式填空),检验的试剂是无水硫酸铜粉末.
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①的离子方程式是2OH-+NH4++HSO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-.
分析 (1)E常温下为无色无味的液体,F为淡黄色粉末,二者反应生成常见的无色气体G,应是过氧化钠与水反应生成氢氧化钠与氧气,则E为H2O,F为Na2O2,G为O2,H为NaOH;
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则A为C,B为浓硫酸,C为二氧化硫,D为二氧化碳;
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,则D为氨气,且B遇盐酸产生能使品红溶液褪色的气体,则B为亚硫酸氢铵.
解答 解:(1)E常温下为无色无味的液体,F为淡黄色粉末,二者反应生成常见的无色气体G,应是过氧化钠与水反应生成氢氧化钠与氧气,则E为H2O,F为Na2O2,G为O2,H为NaOH,NaOH的电子式为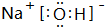 ,
,
故答案为: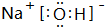 ;
;
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则A为C,B为浓硫酸,C为二氧化硫,D为二氧化碳,则反应①的化学方程式是:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,用无水硫酸铜检验水蒸气,用品红溶液检验二氧化硫,用石灰水检验二氧化碳,由于气体加热溶液中会带出水蒸气,故先检验水蒸气,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;H2O;无水硫酸铜粉末;
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,则D为氨气,且B遇盐酸产生能使品红溶液褪色的气体,则B为亚硫酸氢铵,在加热条件下,当A过量时,反应①的离子方程式是:2OH-+NH4++HSO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-,
故答案为:2OH-+NH4++HSO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-.
点评 本题考查无机物的推断,物质的颜色、气味、状态及特殊性质是推断突破口,熟练掌握元素化合物知识,题目难度中等.

| A. | Y的简单离子半径小于W的简单离子半径 | |
| B. | W、X形成的化合物为离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Z的气态简单氢化物的稳定性比X的强 |
| A. | KCl | B. | NH3 | C. | NaNO3 | D. | CH3COOH |
| A. | NH3 | B. | H2 | C. | HCl | D. | CO2 |
| A. | 聚二氧化碳塑料是通过缩聚反应生成的 | |
| B. | 聚二氧化碳塑料的结构式可表示为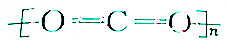 | |
| C. | 聚二氧化碳塑料属于纯净物,相对分子质量为44n | |
| D. | 聚二氧化碳塑料是属于环境友好材料 |
| A. | 4.0gCuO和Cu2S的混合物含铜离子个数为0.05NA | |
| B. | 标准状况下,11.2LC5H12蒸气所含甲基数目最多为NA | |
| C. | 0.5molK与O2完全反应生成K2O,K2O2,KO3的混合物,转移电子数为0.5NA | |
| D. | 1L 0.2mol•L-1HI溶液中含I-数目为0.2NA |
| A. | 16g${\;}_{\;}^{18}$O3中含有的中子数为10NA | |
| B. | 密闭条件下,2molSO2和1molO2在密闭容器中充分反应后容器中的分子数大于2NA | |
| C. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| D. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑,若有5molH2O参加反应,则被谁还原BrF3的分子数目为3NA |
 氨在国防、工农业等领域发挥着重要作用.
氨在国防、工农业等领域发挥着重要作用.(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
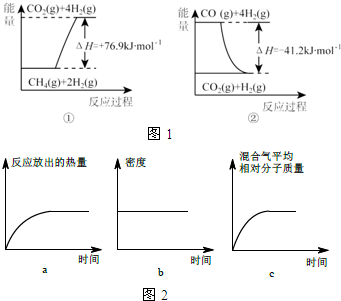
①过程Ⅰ中,有关化学反应的能量变化如图1所示
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1kJ/mol.
②CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
③如表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n (N2)=0.1mol,
n (H2)=0.3mol.图2图象能正确表示该过程中相关量的变化的是ab.(选填字母).