题目内容
3. 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.请回答:
(1)以上操作步骤中有一步有错误,请指出编号①,该错误操作会导致测定结果偏大(填“偏大”、“偏小”或“无影响”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙中.(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:BC(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断到达滴定终点的现象是:锥形瓶中溶液从无 色变为浅红色,且半分钟之内不再改变.
(5)以下是实验数据记录表:
| 滴定次数 | 盐酸体积(ml) | NaOH溶液体积读数(ml) | |
| 滴定前 | 滴定后 | ||
| 20.00 | 0.00 | 16.30 | |
| 2 | 20.00 | 0.00 | 16.22 |
分析 (1)①滴定管用蒸馏水洗完后,必须润洗;不润洗滴定管,会使标准液的浓度减小,消耗的氢氧化钠的体积增大,浓度偏高;
(2)甲是酸式滴定管,乙是碱式滴定管;
(3)A.锥形瓶有水,不影响滴定结果;
B.碱式滴定管尖嘴有气泡,消耗的标准液增大,结果偏高;
C.锥形瓶用待测液润洗,物质的量增大,测定结果偏高;
D.待测液有损失,消耗的标准液减小,浓度偏低;
(4)滴定到溶液有无色变成浅红色时,且半分钟之内不再改变,滴定结束;
(5)算出消耗氢氧化钠溶液的体积,求出平均值,再计算出盐酸的浓度.
解答 解:(1)①滴定管用蒸馏水洗后,必须用氢氧化钠溶液润洗,故①操作有误;不润洗,标准液的浓度减小,消耗的体积增大,根据c(待测)=$\frac{V(标准)×C(标准)}{V(待测)}$,c(待测)偏大,测定结果偏大;
故答案为:①;偏大;
(2)氢氧化钠应该用碱式滴定管,乙具有橡皮管和玻璃球的特征为碱式滴定管,故选乙;
故答案为:乙;
(3)A.在锥形瓶装液前,留有少量蒸馏水,不影响滴定结果,故A错误;
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡,消耗的标准液增大,c(待测)=$\frac{V(标准)×C(标准)}{V(待测)}$,滴定结果偏高,故B正确;
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗,导致待测液增多,消耗标准液增大,c(待测)=$\frac{V(标准)×C(标准)}{V(待测)}$,滴定结果偏高,故C正确;
D.一滴待测液滴在锥形瓶外,消耗的标准液减少,c(待测)=$\frac{V(标准)×C(标准)}{V(待测)}$,滴定结果偏低,故D错误;
故选BC;
(4)标准NaOH溶液滴定未知浓度的盐酸,酚酞溶液做指示剂,到达滴定终点时,溶液由无色变为浅红色,且半分钟内不再变化;
故答案为:无;浅红;
(5)两次消耗氢氧化钠溶液的体积为:16.30mL、16.22mL;平均值为$\frac{16.30+16.22}{2}$=16.26(mL),c(HCl)=$\frac{n(NaOH)}{0.020L}$=$\frac{0.01626L×0.2000mol{L}^{-1}}{0.020L}$≈0.16mol/L;
故答案为:0.16.
点评 本题考查酸碱中和滴定,涉及了滴定过程,误差分析,浓度求算等知识,熟记酸碱中和滴定的实验步骤和注意事项,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范的实验设计能力,题目难度中等.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案| A. | 16g${\;}_{\;}^{18}$O3中含有的中子数为10NA | |
| B. | 密闭条件下,2molSO2和1molO2在密闭容器中充分反应后容器中的分子数大于2NA | |
| C. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| D. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑,若有5molH2O参加反应,则被谁还原BrF3的分子数目为3NA |
 氨在国防、工农业等领域发挥着重要作用.
氨在国防、工农业等领域发挥着重要作用.(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
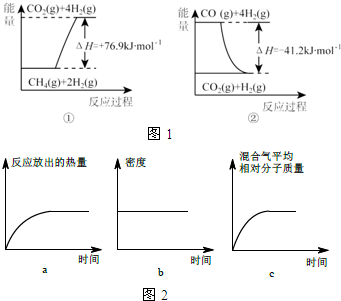
①过程Ⅰ中,有关化学反应的能量变化如图1所示
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1kJ/mol.
②CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
③如表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
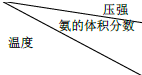
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n (N2)=0.1mol,
n (H2)=0.3mol.图2图象能正确表示该过程中相关量的变化的是ab.(选填字母).
| A. | 热稳定性:H2Se>H2S | B. | 原子半径:Se>O | ||
| C. | 酸性:H2SO4>H2SeO4 | D. | 还原性:Se2->Cl- |
| A. | 铜片投入FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | AgCl悬浮液中加入Na2S溶液沉淀变黑:2AgCl+S2-═Ag2S+2Cl- | |
| C. | 用两根铁电极电解CuSO4溶液:2Cu 2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ | |
| D. | Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$$\stackrel{滴加硝酸钡溶液}{→}$白色沉淀$\stackrel{滴加稀盐酸}{→}$沉淀不溶解→说明试样已变质 | |
| B. | 检验某溶液中是否含有Fe2+:试样$\stackrel{滴加硫氰化钾}{→}$溶液颜色无变化$\stackrel{滴加氯水}{→}$溶液变红色→溶液中含有Fe2+ | |
| C. | 除去粗盐中含有的硫酸钙杂质:粗盐$\stackrel{溶解}{→}$$\stackrel{足量硝酸钠溶液}{→}$$\stackrel{足量氯化钡溶液}{→}$$\stackrel{过滤}{→}$$\stackrel{滤液中滴加盐酸}{→}$$\stackrel{蒸发结晶}{→}$精盐 | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液$\stackrel{30%过氧化氢、稀硝酸}{→}$$\stackrel{淀粉}{→}$溶液变紫色→氧化性:H2O2>I2 |
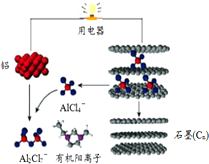 斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时,该电池负极应连接外接电源的负极 | |
| B. | 放电时,电子从铝流出经过电解质溶液到达石墨电极 | |
| C. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- |
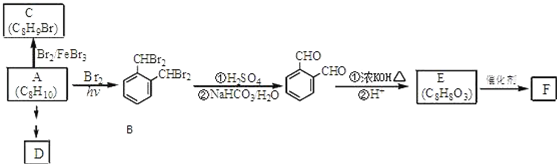
 ;
;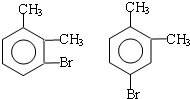 ;
;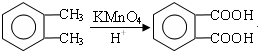 ;
; .(提示
.(提示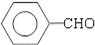 $\underset{\stackrel{①浓KOH、△}{→}}{②{H}^{+}}$
$\underset{\stackrel{①浓KOH、△}{→}}{②{H}^{+}}$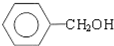 +
+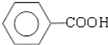 )
)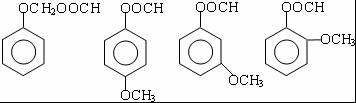 .
.