题目内容
18.NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 100mL 12mol•L-1盐酸溶液与足量MnO2共热,反应生成的气体分子数为0.3NA | |
| B. | 密闭反应容器中充入2mol SO2和1mol O2,充分反应转移电子数为4NA | |
| C. | 25.0g胆矾晶体溶于水配成1L溶液,所得溶液中阳离子数为0.1NA | |
| D. | 常温常压下,0.1mol C5H12所含有的共价键数目为1.6NA |
分析 A.二氧化锰只能与浓盐酸反应,和稀盐酸不反应;
B.二氧化硫与氧气反应生成三氧化硫为可逆反应,不能进行到底;
C.铜离子为弱碱阳离子,水溶液中部分水解;
D.1个C5H12分子含有4个C-C和12个C-H,共16个共价键;
解答 解:A.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,即盐酸不能反应完全,生成氯气分子数小于0.3NA,故A错误;
B.2mol SO2和1mol O2,不可能完全反应生成2mol三氧化硫,所以充分反应转移电子数小于4NA,故B错误;
C.25.0g胆矾物质的量为0.1mol,完全电离生成0.1mol铜离子,铜离子为弱碱阳离子,水溶液中部分水解,所以所得溶液中阳离子数小于0.1NA,故C错误;
D.1个C5H12分子含有4个C-C和12个C-H,共16个共价键,则0.1mol C5H12所含有的共价键数目为1.6NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确可逆反应不能进行到底特点、熟悉盐类水解规律、戊烷分子所含化学键类型及数目是解题关键,题目难度中等.

练习册系列答案
相关题目
15.低血糖患者常需补充葡萄糖.组成葡萄糖的元素有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
16.NA为阿伏加德罗常数,下列说法不正确的是( )
| A. | 4.0gCuO和Cu2S的混合物含铜离子个数为0.05NA | |
| B. | 标准状况下,11.2LC5H12蒸气所含甲基数目最多为NA | |
| C. | 0.5molK与O2完全反应生成K2O,K2O2,KO3的混合物,转移电子数为0.5NA | |
| D. | 1L 0.2mol•L-1HI溶液中含I-数目为0.2NA |
6.下列叙述中错误的是( )
| A. | 通式CnH2n+2 只表示一类物质 | |
| B. | C3H8光照下与氯气反应,最多能生成四种二氯代烃 | |
| C. | 戊烷有3种同分异构体 | |
| D. | 甲苯一氯取代物有3种 |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 16g${\;}_{\;}^{18}$O3中含有的中子数为10NA | |
| B. | 密闭条件下,2molSO2和1molO2在密闭容器中充分反应后容器中的分子数大于2NA | |
| C. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| D. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑,若有5molH2O参加反应,则被谁还原BrF3的分子数目为3NA |
3.化学与科技、工农业生产、国防、生活等领域联系密切,下列说法正确的是( )
| A. | 凡是含有食品添加剂的食物对人体健康有害,不宜食用 | |
| B. | 乙醇和汽油都属于可再生能源,应大力推广使用乙醇汽油 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | PM2.5是指大气中直径≤2.5微米的颗粒物,其颗粒直径小,面积大,活性强,易附带有毒、有害物质(如重金属、微生物等),对人体健康和大气环境质量的影响很大 |
10.已知分解1molKClO3放出热量38.8kJ.当MnO2作催化剂时KClO3的分解机理为:
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
| A. | 1molKClO3所具有的总能量高于1molKCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1gKClO3,1gMnO2,0.1g Mn2O7混合加热,充分反应后MnO2质量为1g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
8.下列实验设计能够成功的是( )
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$$\stackrel{滴加硝酸钡溶液}{→}$白色沉淀$\stackrel{滴加稀盐酸}{→}$沉淀不溶解→说明试样已变质 | |
| B. | 检验某溶液中是否含有Fe2+:试样$\stackrel{滴加硫氰化钾}{→}$溶液颜色无变化$\stackrel{滴加氯水}{→}$溶液变红色→溶液中含有Fe2+ | |
| C. | 除去粗盐中含有的硫酸钙杂质:粗盐$\stackrel{溶解}{→}$$\stackrel{足量硝酸钠溶液}{→}$$\stackrel{足量氯化钡溶液}{→}$$\stackrel{过滤}{→}$$\stackrel{滤液中滴加盐酸}{→}$$\stackrel{蒸发结晶}{→}$精盐 | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液$\stackrel{30%过氧化氢、稀硝酸}{→}$$\stackrel{淀粉}{→}$溶液变紫色→氧化性:H2O2>I2 |
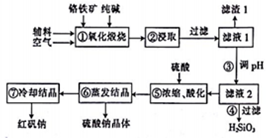 红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.
红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.