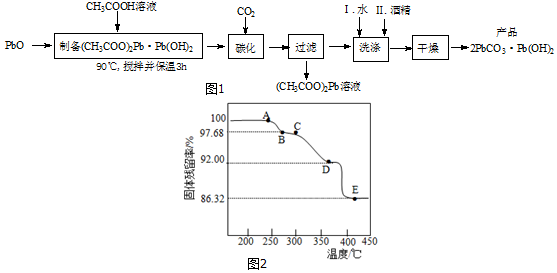
题目内容
16.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g).下列说法正确的是( )| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
分析 A.升高温度正逆反应速率都增大;
B.反应达到平衡后,正逆反应速率相等,且不变;
C.催化剂增大正逆反应速率;
D.达到平衡状态,单位时间内消耗CO和CO2的物质的量相等.
解答 解:A.无论放热反应还是吸热反应,升高温度正逆反应速率都增大,故A错误;
B.反应达到平衡后,正逆反应速率相等,且不变,所以反应达到平衡后,NO的反应速率保持恒定,故B正确;
C.催化剂改变活化能,催化剂增大正逆反应速率,所以使用高效催化剂可有效提高正逆反应速率,故C错误;
D.达到平衡状态,单位时间内消耗CO和CO2的物质的量相等,即正逆反应速率,所以能据此判断平衡状态,故D正确;
故选BD.
点评 本题考查化学反应速率影响因素、化学平衡状态的判断等知识点,知道只有反应前后改变的物理量才能作为平衡状态的判断依据,题目难度不大.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
14.能使湿润的淀粉KI试纸变蓝的是( )
①氯水 ②溴水 ③碘水 ④氯化钠 ⑤溴化钾.
①氯水 ②溴水 ③碘水 ④氯化钠 ⑤溴化钾.
| A. | ①② | B. | ①②③ | C. | ①②④ | D. | ①③⑤ |
11.如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )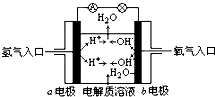

| A. | b电极是负极 | |
| B. | 总反应方程式为:2H2+O2═2H2O | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 氢氧燃料电池是一种具有广泛应用前景的绿色电源 |
8.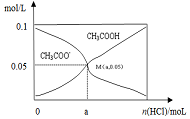 常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
 常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )
常温下向10mL 0.1mol•L-1CH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,c(H+)-c(OH-)=(100a-5.0×10-2) mol/L | |
| C. | 随着HCl的通入,$\frac{c(O{H}^{-})}{c(C{H}_{2}CO{O}^{-})}$值不断减小 | |
| D. | 当n(HCl)=1.0×10-3mol时,溶液中c(Na+)>c(Cl-)>c(CHCOO-)>c(H+)>c(OH-) |
5.下列关于物质的量的叙述中,正确的是( )
| A. | 1 mol任何物质中都含有6.02×1023个分子 | |
| B. | 0.012 kg 12C中含有约6.02×1023 NA个碳原子 | |
| C. | 1 mol水中含有1 mol氢分子和1 mol氧原子 | |
| D. | 1 mol Ne中约含有6.02×1024个电子 |
6.关于某混合物的说法正确的是( )
| A. | 构成物质一定是化合物 | |
| B. | 构成物质一定是单质 | |
| C. | 构成物质可能只有一种元素 | |
| D. | 物质的组成元素一定是两种或两种以上 |