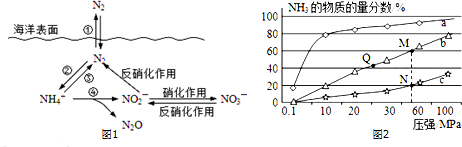
题目内容
11.如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )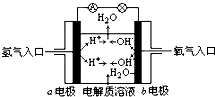
| A. | b电极是负极 | |
| B. | 总反应方程式为:2H2+O2═2H2O | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 氢氧燃料电池是一种具有广泛应用前景的绿色电源 |
分析 氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极是负极,氧气易得电子发生还原反应,所以通入氧气的电极是正极;当电解质溶液是氢氧化钾时,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子生成氢氧根离子;当电解质溶液是酸时,负极上氢气生成氢离子,正极上氧气和氢离子反应生成水.
解答 解:A.燃料电池中,通入氧气的电极b是正极,所以b电极是正极,故A错误;
B.总反应即氢气燃烧生成水,方程式为:2H2+O2═2H2O,故B正确;
C.氢氧燃料电池中,负极氢气易失电子发生氧化反应,正极氧气易得电子发生还原反应,故C错误;
D.氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,故D正确;
故选AC.
点评 本题考查了燃料电池,要注意的是:虽然燃料相同,但电解质溶液不同时,电极反应式就不同,如氢氧燃料电池,在酸性介质和碱性介质中的电极反应式就不同.

练习册系列答案
相关题目
8.我国“长征二号”火箭的主要燃料是偏二甲肼(用R表示),在火箭发射时,偏二甲肼与四氧化二氮剧烈反应,产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4═3N2+4H2O+2CO2,下列说法错误的是( )
| A. | 此反应是氧化还原反应 | |
| B. | N2O4在反应中作还原剂 | |
| C. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| D. | R的分子式为C2H8N2 |
6.下列事实中一定能证明HClO是弱电解质的是( )
(1)pH相等的H2SO4和HClO与足量的强碱反应,HClO消耗的强碱体积大
(2)用HClO溶液做导电性实验,灯泡很暗
(3)NaClO溶液中有HClO分子存在
(4)HClO溶液有很强的氧化性
(5)等体积,等物质的量浓度的HClO与NaOH溶液恰好完全反应
(6)盐酸与KClO溶液反应生成HClO
(7)1mol/L的HClO溶液能使紫色石蕊试液先变红后褪色.
(1)pH相等的H2SO4和HClO与足量的强碱反应,HClO消耗的强碱体积大
(2)用HClO溶液做导电性实验,灯泡很暗
(3)NaClO溶液中有HClO分子存在
(4)HClO溶液有很强的氧化性
(5)等体积,等物质的量浓度的HClO与NaOH溶液恰好完全反应
(6)盐酸与KClO溶液反应生成HClO
(7)1mol/L的HClO溶液能使紫色石蕊试液先变红后褪色.
| A. | (1)(2)(3) | B. | (1)(3)(6) | C. | (1)(2)(5)(6) | D. | (1)(3)(6)(7) |
16.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g).下列说法正确的是( )
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
20.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,22.4LSO3所含的分子数为NA | |
| B. | 49g硫酸中所含氧原子的数目为2NA | |
| C. | 1molNH4+所含质子数为10NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
1.能用离子方程式H++SO42-+OH-+Ba2+═BaSO4↓+H2O 来表示的反应是( )
| A. | 等物质的量浓度等体积的稀硫酸和氢氧化钡溶液反应 | |
| B. | 稀硫酸和过量氢氧化钡溶液反应 | |
| C. | 硫酸氢钠溶液和过量氢氧化钡溶液反应 | |
| D. | 硫酸氢钠溶液和少量氢氧化钡溶液反应 |
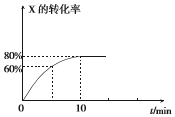 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应: