题目内容
1.向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的大小关系为△H3>△H2>△H1.分析 在稀溶液中强酸与强碱生成1molH2O放出的热量为中和热,注意弱电解质的电离吸热,浓硫酸溶于水放热,据此进行解答.
解答 解:强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)十OH-(aq)=H2O;△H=-57.3kJ/mol,
分别向1L 0.5mol/L的NaOH溶液中加入:①浓H2SO4;②稀硝酸;③稀醋酸,
浓硫酸溶于水放热,醋酸的电离吸热,则1L 1mol/L的NaOH溶液恰好完全反应时的放出的热量为:①>③>③,焓变为负值,则△H3>△H2>△H1,
故答案为:△H3>△H2>△H1.
点评 本题考查了反应热与焓变关系,题目难度不大,明确反应热与焓变之间的关系为解答关键,注意放热反应中,放出热量越大,焓变越小,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
18.下列实验操作中正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
16.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g).下列说法正确的是( )
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
13.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
10.下列表示式中错误的是( )
| A. | Na+的电子式: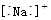 | B. | Na+的结构示意图: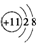 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:3s1 |
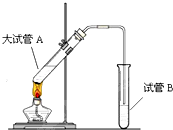 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题: ②
②