题目内容
13.PbO2及2PbCO3•Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料.(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到.
①Pb(NO3)2被氧化为PbO2的离子方程式为Pb2++ClO-+H2O=PbO2↓+Cl-+2H+.
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq)?PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K=2.6×1061已知:Ksp(PbS)=3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15].
(2)制备碱式碳酸铅的实验步骤如图1:
①“碳化”时,发生反应的化学方程式为3[(CH3COO)2Pb•Pb(OH)2]+2CO2=3(CH3COO)2Pb+2PbCO3•Pb(OH)2↓+2H2O.
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是除去沉淀表面附着的水并促进其快速干燥.
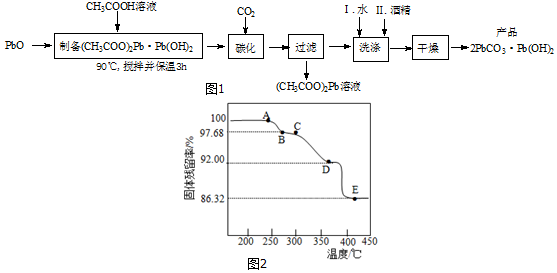
(3)为确定2PbCO3•Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图2所示.
①A→B过程中,从体系中逸出的分解产物(化合物)为H2O(填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为CO2(填化学式).
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程).
分析 (1)①Pb(NO3)2被NaClO氧化为PbO2,NaClO被还原成氯离子,据此书写反应的离子方程式;
②根据平衡常数等于生成物浓度的系数次幂之积除以反应物浓度系数次幂之积计算平衡常数;
(2)制备碱式碳酸铅的流程为用氧化铅与醋酸反应生成CH3COO)2Pb•Pb(OH)2,再用CH3COO)2Pb•Pb(OH)2与二氧化碳反应生成2PbCO3•Pb(OH)2,经过滤后先用水洗涤,再用酒精洗涤,以除去表面的水份同时可以快速干燥,得纯净2PbCO3•Pb(OH)2的产品;
(3)根据图可知加热后得固体的质量分数,结合2PbCO3•Pb(OH)2的相对式量:775,可知加热过程中产生的物质及剩余的固体的成份.
解答 解:(1)①Pb(NO3)2被NaClO氧化为PbO2,NaClO被还原成氯离子,反应的离子方程式为Pb2++ClO-+H2O=PbO2↓+Cl-+2H+,
故答案为:Pb2++ClO-+H2O=PbO2↓+Cl-+2H+;
②根据反应Pb2+(aq)+H2S(aq)?PbS(s)+2H+(aq),平衡常数K=$\frac{{c}^{2}({H}^{+})}{c({H}_{2}S)c(P{b}^{2+})}$=$\frac{K{a}_{1}×K{a}_{2}}{Ksp(PbS)}$=2.6×106,
故答案为:2.6×106;
(2)①“碳化”时,用CH3COO)2Pb•Pb(OH)2与二氧化碳反应生成2PbCO3•Pb(OH)2,发生反应的化学方程式为 3[(CH3COO)2Pb•Pb(OH)2]+2CO2=3(CH3COO)2Pb+2PbCO3•Pb(OH)2↓+2H2O,
故答案为:3[(CH3COO)2Pb•Pb(OH)2]+2CO2=3(CH3COO)2Pb+2PbCO3•Pb(OH)2↓+2H2O;
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是除去表面的水份同时可以快速干燥,得纯净2PbCO3•Pb(OH)2的产品,
故答案为:除去沉淀表面附着的水并促进其快速干燥;
(3)①根据图可知加热后得固体的质量分数,结合2PbCO3•Pb(OH)2的相对式量:775,所以1mol2PbCO3•Pb(OH)2的质量为775g,A→B过程中,$\frac{△{m}_{1}}{M[2PbCO{\;}_{3}•Pb(OH){\;}_{2}]}=\frac{△{m}_{1}}{775g}$=1-0.9768,所以△m1=18g,减少的是H2O;C→D过程中,$\frac{△{m}_{2}}{775g}$=0.9768-0.9200,所以△m2=44g,减少的是CO2,
故答案为:H2O;CO2;
②1mol2PbCO3•Pb(OH)2的质量为775g,A→B过程中,$\frac{△{m}_{1}}{M[2PbCO{\;}_{3}•Pb(OH){\;}_{2}]}=\frac{△{m}_{1}}{775g}$=1-0.9768,所以△m1=18g,减少的是H2O;C→D过程中,$\frac{△{m}_{2}}{775g}$=0.9768-0.9200,所以△m2=44g,减少的是CO2;D→E过程中,$\frac{△m{\;}_{3}}{775g}$=0.9200-0.8632,△m3=44g,减少的是CO2,2PbCO3•Pb(OH)2共脱去1个H2O及2个CO2,故E点残留固体为PbO,
答:E点残留固体的化学式为PbO.
点评 本题考查了探究物质组成、测量物质含量及性质实验方案的设计,题目难度中等,注意掌握物质的性质及检验方法,正确分析曲线变化为解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯、苯与硝酸作用得到一硝基取代物的反应条件分别为30℃、50-60℃ |
| A. | 此反应是氧化还原反应 | |
| B. | N2O4在反应中作还原剂 | |
| C. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| D. | R的分子式为C2H8N2 |
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| A. | 倭铅是指金属锌和铅的混合物 | B. | 煤炭中起作用的主要成分是C | ||
| C. | 我国历史上铅的使用早于锌 | D. | 该冶炼锌的方法属于热还原法 |
| A. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| C. | 0.5 mol•L-1MgCl2溶液中,含有Cl-个数为NA | |
| D. | 18 g NH4+中所含的电子数为11NA |
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
 有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.
有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.