题目内容
H2SO3、H2CO3分别属于中强酸和弱酸,H2SO3?H++HSO3-,HSO3-?H++SO32-;H2CO3?H++HCO3-;HCO3-?H++CO32-;电离平衡常数分别为k1、k1′、k2、k2′,已知k1>k1′≈k2>k2′,则溶液中不可以大量共存的离子组合是( )
| A、SO32-、HCO3- |
| B、HSO3-、CO32- |
| C、SO32-、CO32- |
| D、HSO3-、HCO3- |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:H2SO3?H++HSO3-、HSO3-?H++SO32-、H2CO3?H++HCO3-、HCO3-?H++CO32-、电离平衡常数分别为k1、k1′、k2、k2′,电离平衡常数越大其酸性越强,k1>k1′≈k2>k2′,说明酸性强弱顺序是H2SO3>HSO3-≈H2CO3>HCO3-,强酸能和弱酸盐反应生成弱酸,据此分析解答.
解答:
解:H2SO3?H++HSO3-、HSO3-?H++SO32-、H2CO3?H++HCO3-、HCO3-?H++CO32-、电离平衡常数分别为k1、k1′、k2、k2′,电离平衡常数越大其酸性越强,k1>k1′≈k2>k2′,说明酸性强弱顺序是H2SO3>HSO3-≈H2CO3>HCO3-,强酸能和弱酸盐反应生成弱酸,所以HSO3-、CO32-能相互反应而不能共存,
故选B.
故选B.
点评:本题考查弱电解质的电离及强酸制取弱酸等知识点,明确电离平衡常数大小与酸强弱关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
下列做法合理的是( )
| A、为了使食品较长时间保持色香味和口感,可加放适量的苯甲酸钠 |
| B、为了增加婴幼儿奶粉中的含氮量,可在奶粉中适当添加尿素或三聚氰胺 |
| C、在肉制品加工中加大量的亚硝酸钠以保持肉类新鲜 |
| D、在缺碘地区,人们需要用添加碘单质的食盐来补充碘元素 |
下列实验现象描述正确的是( )
| A、氯化氢与氨气相遇,有大量的白雾生成 |
| B、SO2通入品红溶液,红色褪去,再加热,红色不再出现 |
| C、SO2具有氧化性,可用于漂白纸浆 |
| D、用铂丝蘸取硫酸钠溶液灼烧,火焰呈黄色 |
下列说法正确的是( )
| A、pH<7的溶液一定呈酸性 |
| B、0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)相等 |
| C、pH为1的盐酸的c(H+)是pH为3的盐酸的100倍 |
| D、Na2 CO3溶液中,c(Na+)是c(CO32-)的两倍 |
今有一种固体化合物,本身不导电,但在熔融状态下或溶于水时能够电离.下列说法中正确的是( )
| A、该物质一定为电解质 |
| B、该物质可能为非电解质 |
| C、该物质一定是氯化钠 |
| D、该物质一定是氢氧化钠 |
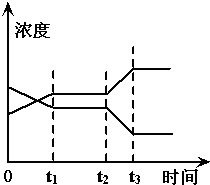 现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )| A、增大压强 |
| B、使用了催化剂 |
| C、升高温度 |
| D、减小了X或Y的浓度 |
由CaCO3和MgCO3组的混和物充分加热至质量不再减少时,称得残留的固体质量是原混和物的一半,则残留物中钙、镁两元素原子的物质的量之比( )
| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |