题目内容
下列说法正确的是( )
| A、pH<7的溶液一定呈酸性 |
| B、0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)相等 |
| C、pH为1的盐酸的c(H+)是pH为3的盐酸的100倍 |
| D、Na2 CO3溶液中,c(Na+)是c(CO32-)的两倍 |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A、溶液的酸碱性和pH大小以及溶液的温度有关;
B、氢氧化钾是强碱,氨水是弱碱;
C、盐酸是强酸,根据酸中氢离子的浓度来计算;
D、碳酸钠溶液中,碳酸根离子会水解,钠离子不会.
B、氢氧化钾是强碱,氨水是弱碱;
C、盐酸是强酸,根据酸中氢离子的浓度来计算;
D、碳酸钠溶液中,碳酸根离子会水解,钠离子不会.
解答:
解:A、pH<7的溶液不一定呈酸性,如当温度高于常温,pH<7的水可以是中性的,故A错误;
B、0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)不相等,前者的大,故B错误;
C、pH为1的盐酸的c(H+)是0.1mol/L,pH为3的盐酸的c(H+)是0.001mol/L,pH为1的盐酸的c(H+)是pH为3的盐酸的100倍,故C正确;
D、Na2CO3溶液中,碳酸根离子水解,c(Na+)是c(CO32-)的两倍还要多,故D错误.
故选C.
B、0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)不相等,前者的大,故B错误;
C、pH为1的盐酸的c(H+)是0.1mol/L,pH为3的盐酸的c(H+)是0.001mol/L,pH为1的盐酸的c(H+)是pH为3的盐酸的100倍,故C正确;
D、Na2CO3溶液中,碳酸根离子水解,c(Na+)是c(CO32-)的两倍还要多,故D错误.
故选C.
点评:本题涉及弱电解质的电离、溶液pH的计算以及盐的水解规律以及应用等知识,可以根据所学知识来回答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
使用玻璃棒不能达到下列目的是( )
| A、引流 |
| B、防止液体溅出 |
| C、增加物质的溶解度 |
| D、加快物质的溶解速度 |
用镁铝合金制作的窗框、卷帘门、防护栏等物品轻巧、美观、耐用.与上述这些特点无关的镁铝合金的性质是( )
| A、不易生锈 | B、导电性好 |
| C、密度小 | D、强度高 |
常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( )
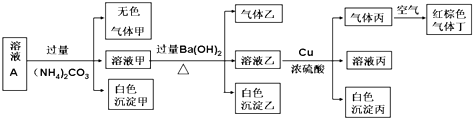

| A、沉淀乙一定有BaCO3,可能有BaSO4 |
| B、实验消耗Cu 14.4g,则生成气体丁的体积为3.36L |
| C、该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 |
| D、生成的甲、乙、丙气体均为无色的易溶于水气体 |
25℃时,下列液体的pH大于7的是( )
| A、蒸馏水 | B、人的胃液 |
| C、醋酸钠溶液 | D、氯化铵溶液 |
H2SO3、H2CO3分别属于中强酸和弱酸,H2SO3?H++HSO3-,HSO3-?H++SO32-;H2CO3?H++HCO3-;HCO3-?H++CO32-;电离平衡常数分别为k1、k1′、k2、k2′,已知k1>k1′≈k2>k2′,则溶液中不可以大量共存的离子组合是( )
| A、SO32-、HCO3- |
| B、HSO3-、CO32- |
| C、SO32-、CO32- |
| D、HSO3-、HCO3- |
100mL 6mol/L H2SO4跟过量锌粉反应,恒温下,为减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量某物质或溶液,其中不能达到目的是( )
| A、醋酸钠(固体) |
| B、水 |
| C、硫酸钾溶液 |
| D、硫酸铵(固体) |
下列反应中属于吸热反应的是( )
| A、Ba(OH)2?8H2O(s)+NH4Cl(s) |
| B、酸碱中和反应 |
| C、铝热反应 |
| D、实验室制取氢气的反应 |
 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0