题目内容
6.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是( )| A. | ClO-、Na+、SO42-、NO3- | B. | Na+、Mg2+、S2-、SO${\;}_{{3}^{\;}}$2- | ||
| C. | Na+、K+、Cl-、OH- | D. | K+、Ca2+、H+、NO${\;}_{3}^{-}$ |
分析 溶液无色,则不含有颜色的离子,若加入溴水,溴水褪色,溶液可能呈碱性或含有还原性离子,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,说明溶液呈碱性,结合离子之间能否大量共存进行判断.
解答 解:溶液无色,则不含有颜色的离子,若加入溴水,溴水褪色,溶液可能呈碱性或含有还原性离子,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,说明溶液呈碱性,
A.加入溴水,因无还原性离子,则溴水不褪色,故A错误;
B.溶液呈碱性,则Mg2+不能大量共存,故B错误;
C.溶液无色,呈碱性,加入溴水褪色,并且加入NH4HCO3,固体溶解并产生刺激性气味的气体,符合题目要求,故C正确;
D.碱性条件下H+不能大量存在,故D错误.
故选C.
点评 本题考查离子共存问题,为高考常见题型,侧重于元素化合物知识的综合理解和运用的考查,题目难度中等,本题注意把握题给信息,为解答该题的关键,注意溴与碱的反应,与氯气与碱的反应相似.

练习册系列答案
相关题目
16.不属于“氮的固定”的变化是( )
| A. | 豆科植物的根瘤菌固氮 | B. | .由氮气和氢气合成氨气 | ||
| C. | .雷雨天,空气中的氮气和氧气反应 | D. | .氨催化氧化制硝酸 |
17.下列化合物中,既含有离子键又含有共价键的是( )
| A. | H2O2 | B. | Na2O | C. | CO2 | D. | NaOH |
11.2009年7月27日,俄科学家用钙-48原子轰击锫-249原子,预期得到117号超重元素,下列关于117号元素叙述正确的是( )
| A. | 该合成过程是化学变化 | B. | 该元素在第七周期ⅤⅡA族 | ||
| C. | 该元素是非金属性比较强的元素 | D. | 该元素形成的氢化物比较稳定 |
2.用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的流程如图.
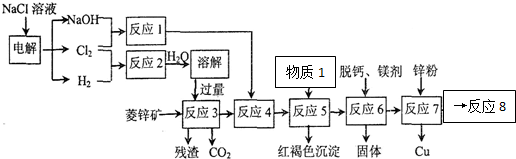
(1)电解饱和食盐水,H2在阴极生成
(2)在反应3前要将菱锌矿研磨,其目的是增大反应物的接触面积,加快反应速率,提高浸取率
(3)反应4的目的:将Fe2+氧化为Fe3+
(4)物质1最佳选用:C(填符号),调节pH至3.2-6.4(填范围),目的是将Fe3+完全转化为Fe(OH)3除去
A.NH3•H2O B.NaOH C.ZnO
(5)反应8从溶液中获得ZnCl2,加热前需通入足量的HCl气体,目的抑制Zn2+(ZnCl2)的水解.

| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.7 |
| Zn2+ | 6.4 | 8.0 |
(2)在反应3前要将菱锌矿研磨,其目的是增大反应物的接触面积,加快反应速率,提高浸取率
(3)反应4的目的:将Fe2+氧化为Fe3+
(4)物质1最佳选用:C(填符号),调节pH至3.2-6.4(填范围),目的是将Fe3+完全转化为Fe(OH)3除去
A.NH3•H2O B.NaOH C.ZnO
(5)反应8从溶液中获得ZnCl2,加热前需通入足量的HCl气体,目的抑制Zn2+(ZnCl2)的水解.
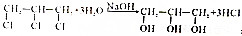 一个碳上连有两个烃基不隐定,容易失去一份水,试回答下列问题:
一个碳上连有两个烃基不隐定,容易失去一份水,试回答下列问题:

 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$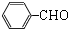 +2NaCl+2H2O
+2NaCl+2H2O .
.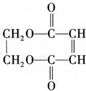 )可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图
)可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图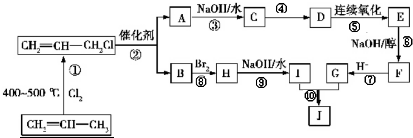
 +3NaOH$→_{△}^{乙醇}$ NaOOC-CH=CH-COONa+NaCl+3H2O;
+3NaOH$→_{△}^{乙醇}$ NaOOC-CH=CH-COONa+NaCl+3H2O;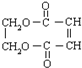 ;
; 氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题: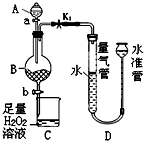 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).