题目内容
11.2009年7月27日,俄科学家用钙-48原子轰击锫-249原子,预期得到117号超重元素,下列关于117号元素叙述正确的是( )| A. | 该合成过程是化学变化 | B. | 该元素在第七周期ⅤⅡA族 | ||
| C. | 该元素是非金属性比较强的元素 | D. | 该元素形成的氢化物比较稳定 |
分析 117号元素原子结构示意图为
A.有新物质生成的变化为化学变化;
B.主族元素原子结构示意图中,其原子核外电子层数与其周期数相同,最外层电子数与其族序数相同;
C.该元素位于At下方,同一主族元素,元素的非金属性随着原子序数增大而减弱;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:117号元素原子结构示意图为
A.有新物质生成的变化为化学变化,该合成过程没有新物质生成,所以不是化学变化,故A错误;
B.主族元素原子结构示意图中,其原子核外电子层数与其周期数相同,最外层电子数与其族序数相同,根据其原子结构示意图知,该元素位于第七周期第VIIA族,故B正确;
C.该元素位于At下方,同一主族元素,元素的非金属性随着原子序数增大而减弱,其非金属性小于At,所以该元素非金属性较弱,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强,该元素在卤族元素中非金属性最强,所以其氢化物稳定性较弱,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断及对元素周期律知识的应用,正确判断该元素在周期表位置是解本题关键,熟练掌握同一主族元素原子结构、元素性质递变规律,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
2.以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3⑦H3O+ ⑧[Ag(NH3)2]OH.
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3⑦H3O+ ⑧[Ag(NH3)2]OH.
| A. | ①④⑥⑦⑧ | B. | ③④⑤⑥⑦ | C. | ①④⑤⑥⑦⑧ | D. | 全部 |
19.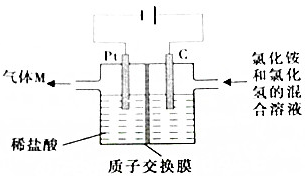 常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )
常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )
 常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )
常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )| A. | 每生产1molNCl3,理论上有4molH+经质子交换膜有右侧向左侧迁移 | |
| B. | 可用湿润的淀粉纸质检验气体M | |
| C. | 石墨极的电极反应式为NH4++3Cl--6e-=NCl3+4H+ | |
| D. | 电解过程中,质子交换膜右侧溶液的pH会减小 |
6.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是( )
| A. | ClO-、Na+、SO42-、NO3- | B. | Na+、Mg2+、S2-、SO${\;}_{{3}^{\;}}$2- | ||
| C. | Na+、K+、Cl-、OH- | D. | K+、Ca2+、H+、NO${\;}_{3}^{-}$ |
16.下列说法中正确的是( )
| A. | 碘酒是指单质碘的乙醇溶液 | |
| B. | 化合反应均为氧化还原反应 | |
| C. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| D. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
4.某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.下列有关说法正确的是( )
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则n(CH3OH)/n(CO2)减小 | |
| C. | 温度升高,反应的平衡常数K增大 | |
| D. | 当CO2和H2转化率相等时,该反应达到化学平衡 |
5.化学工业的很多领域都要用到浓硫酸.工业上接触法制硫酸的简单流程如图1.回答有关问题:
(1)下列生产过程中,可用到硫酸的是BCD;
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸纳”的合成
C.铅蓄电池的生产 D.普钙(磷酸二氢钙和硫酸钙)的制备
(2)根据下表信息,结合工业生产实际,判断最适合SO2反应生成SO3的生产条件是400℃,0.1MPa.
(3)由沸腾炉排出的炉渣中含有Fe203、CuO、CuS04(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度变化如表:
己知CuS04在低于660℃时不会分解,请简要分析上表中CuS04的质最分数随温度升高而降低的原因SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).
(4)用1t黄铁矿(FeS2的质量分数为36%)接触法制硫酸,硫酸的产率为65%,则通过列式计算最后能生产出98%的浓硫酸的质量为0.39t.
(5)某研究小组用NaOH溶液吸收尾气中的SO2,将所得的Na2SO3溶液进行电解再生循环脱硫,其原理如图2所示.a、b离子交换膜将电解槽分成为三个区域,电极材料均为石墨.图中a表示阴(填“阴”或“阳”)离子交换膜.A〜E分别代表生产中的原料或产品,其中A为硫酸溶液,则D为NaOH溶液.阳极的电极反应式为SO32--2e-+H2O=2H++SO42-.

(1)下列生产过程中,可用到硫酸的是BCD;
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸纳”的合成
C.铅蓄电池的生产 D.普钙(磷酸二氢钙和硫酸钙)的制备
(2)根据下表信息,结合工业生产实际,判断最适合SO2反应生成SO3的生产条件是400℃,0.1MPa.
 | 0.1MPa | 0.5MPa | 1MPa | 1.5MPa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(4)用1t黄铁矿(FeS2的质量分数为36%)接触法制硫酸,硫酸的产率为65%,则通过列式计算最后能生产出98%的浓硫酸的质量为0.39t.
(5)某研究小组用NaOH溶液吸收尾气中的SO2,将所得的Na2SO3溶液进行电解再生循环脱硫,其原理如图2所示.a、b离子交换膜将电解槽分成为三个区域,电极材料均为石墨.图中a表示阴(填“阴”或“阳”)离子交换膜.A〜E分别代表生产中的原料或产品,其中A为硫酸溶液,则D为NaOH溶液.阳极的电极反应式为SO32--2e-+H2O=2H++SO42-.
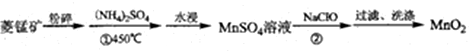
 .
.